


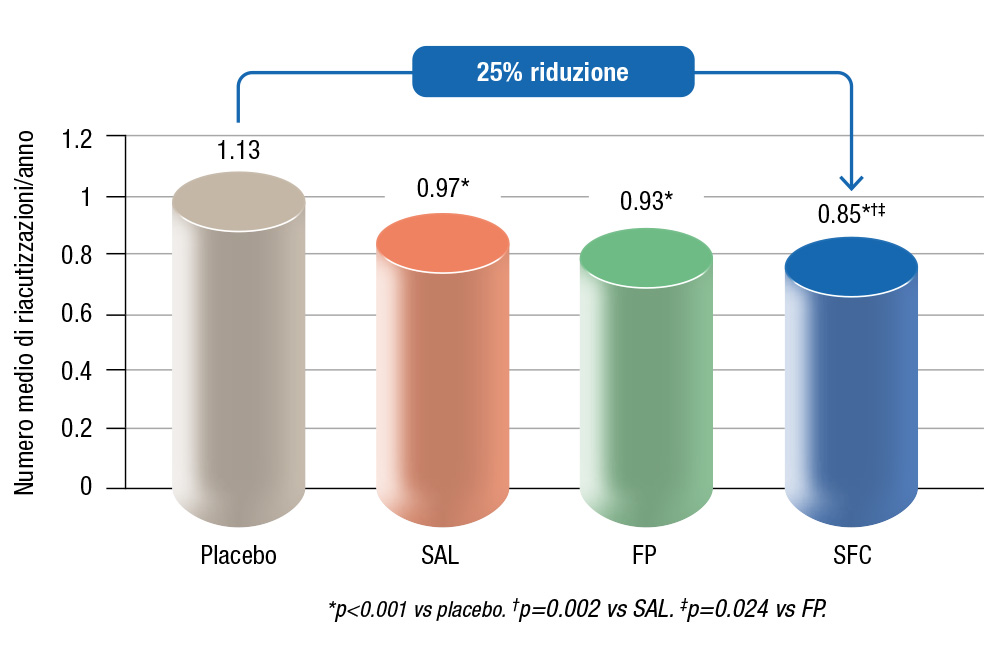
Figura 1. Effetto di salmeterolo (100 μg/die), fluticasone propionato (1000 μg/die), entrambi (combinazione) o placebo sul numero medio di riacutizzazioni moderate-gravi per anno, durante 3 anni. Rielaborazione grafica di figura 4 di (2).
Bibliografia
1) COVID-19 rapid guideline: community-based care of patients with chronic obstructive pulmonary disease (COPD). NICE guideline Published: 9 April 2020 www.nice.org.uk/guidance/ng168.
2) Wedzicha JA et al. COPD exacerbations: defining their cause and prevention. Lancet 2007; 370:786-96.
3) Calverley PM et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356(8):775-89.