

Il cancro alla prostata (PCa) è il secondo tumore più diagnosticato negli uomini, con circa 1,1 milioni di diagnosi in tutto il mondo ogni anno, corrispondente al 15% di tutti i tumori diagnosticati (1). L’incidenza del PCa aumenta con l’età, con oltre il 25% degli uomini di età superiore ai 75 anni colpiti (1). Il PCa a basso rischio (PSA<10 ng/ml, ISUP 1, T2a) può essere gestito attraverso diverse modalità, tra cui l’approccio non operativo della “sorveglianza attiva”, che prevede il monitoraggio di laboratorio e clinico della progressione del tumore e il trattamento attivo se necessario (2).
I tumori prostatici organo-confinati a rischio intermedio/alto richiedono un trattamento attivo, che può includere intervento chirurgico e/o radioterapia (radioterapia esterna o brachiterapia). Circa il 40% delle persone con cancro alla prostata viene sottoposto a radioterapia come parte del loro trattamento, che può avere scopi vari come intento curativo, adiuvante post-operatorio, intento salvavita post-operatorio o intento palliativo (3). La radioterapia convenzionale è somministrata come radioterapia esterna (EBRT) e conformazionale, compresa la radioterapia conformazionale tridimensionale (3DCRT) e la radioterapia a intensità modulata (IMRT).
Durante il trattamento, nonostante i recenti progressi nelle tecniche e nelle tecnologie che consentono una somministrazione precisa della radiazione sull’organo bersaglio, la radioterapia pelvica espone inevitabilmente il tratto gastrointestinale circostante a una certa dose di radiazioni e potenzialmente aumentando il rischio di cancro del retto nel decennio successivo (4). Sono state adottate e implementate diverse strategie per ridurre al minimo queste complicanze; una tecnica mira a fissare la ghiandola prostatica durante il trattamento radiante tramite un palloncino rettale per ridurre il movimento della prostata e assicurare che la dose somministrata al volume bersaglio sia efficace (5,6).
Utilizzando un palloncino rettale, l’esposizione alla dose della parete rettale posteriore è ridotta in maniera significativa. I distanziatori a palloncino biodegradabile sono disponibili ed utilizzati in Europa e rappresentano una valida alternativa al palloncino rettale. L’impianto dei distanziatori è un intervento chirurgico minimamente invasivo eco-guidato che consente il posizionamento di palloncini biodegradabili che possono essere posizionati posteriormente alla prostata per aumentare la separazione tra prostata e retto, proteggendo così quest’ultimo dalle radiazioni durante le sessioni di RT.
Tale approccio richiede la presenza di un medico esperto, qualificato, e la procedura richiede da 10 a 30 minuti e può essere eseguita sotto anestesia locale o generale. Come riportato nelle Linee guida EAU 2022, “... una meta-analisi che include uno studio RCT e sei studi di coorte utilizzando un distanziatore di gel di acido ialuronico ha dimostrato una riduzione del 5-8% nel volume rettale che riceve radiazioni ad alta dose...”(7). Tale device impiega mediamente da 6 a 12 mesi per essere assorbito una volta iniettato nelle regioni di interesse dei pazienti. Le complicanze segnalate del posizionamento dei distanziatori, sebbene rare, sono ascessi prostatici, fistole e sepsi.
Nella nostra pratica clinica, abbiamo arruolato 20 pazienti con diagnosi di cancro alla prostata (PCa) che presentavano un rischio sfavorevole/intermedio e candidati a radioterapia moderatamente ipofrazionata (60 gy in 20 frazioni), tra gennaio 2021 e giugno 2023. Sono stati inclusi nello studio anche pazienti che avevano già ricevuto irradiazione pelvica per morbosità del retto, e non sono stati utilizzati criteri di esclusione nella fase di selezione dei pazienti. I dati valutati sono stati: eventuali complicanze correlate alla procedura, la tollerabilità del dispositivo ed i dati dosimetrici durante il trattamento radiante.
I dati sono stati raccolti in diversi momenti temporali: T0 (il giorno del posizionamento del distanziatore), T1 (una visita di controllo ambulatoriale a 10 giorni) e durante le procedure di radioterapia. Il distanziatore biodegradabile è stato posizionato in regime ambulatoriale con il paziente in posizione litotomica. Sono stati somministrati 1 grammo di cefazolina per via endovenosa e anestesia locale all’area perineale e ai muscoli elevatori dell’ano con mepivacaina al 2%. Il paziente è stato osservato per eventuali complicanze precoci durante il periodo di osservazione post-procedurale prima di essere congedato. Le complicazioni tardive e la tollerabilità del dispositivo sono state valutate a T1.
Sono state registrate: la durata della procedura (in minuti), il tempo di osservazione (in minuti), la gravità (in base all’indice di comorbilità di Charlson) delle complicanze precoci e tardive. La tollerabilità del dispositivo è stata valutata utilizzando una scala da 0 a 10 per il disagio (0=nessun disagio, 10=disagio grave). Dopo la visita T1, il paziente è stato inviato alla radioterapia. Abbiamo inoltre valutato i dati dosimetrici durante la radioterapia. I dati raccolti dai pazienti con il distanziatore prostatico sono stati confrontati con i dati di un gruppo di controllo costituito da 20 pazienti sottoposti al medesimo trattamento radiante, ma in assenza di un distanziatore prostatico.
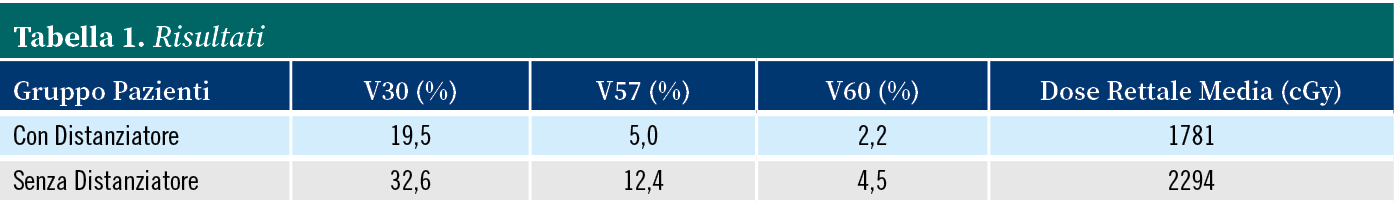
Entrambi i gruppi includevano pazienti con caratteristiche pre-trattamento simili. Per la valutazione della dosimetria rettale in ciascun gruppo abbiamo utilizzato V30, V57, V60 e dose rettale media. La dosimetria V30, V57 e V60 indica la percentuale di volume del retto che riceve una dose di 30, 57 e 60 Gray, rispettivamente.
Il tempo medio della procedura di inserimento dello spacer è stato di 18 minuti (10-25 min). Tutti i pazienti sono stati dimessi entro due ore dalla procedura [tempo medio di osservazione post-operatoria: 90 minuti (45-110 min)], dopo la ripresa della minzione spontanea e l’assenza di complicanze precoci.
Due pazienti hanno avuto ritenzione urinaria acuta risolta con cateterizzazione, e un paziente ha sviluppato un ematoma perineale lieve che non ha richiesto trattamento. Per quanto riguarda le complicanze tardive, un paziente ha sviluppato febbre (>38°C) il giorno successivo alla procedura, richiedendo la continuazione della terapia antibiotica. Alla visita T1, non sono state registrate complicanze di grado medio-alto. La tollerabilità del dispositivo è stata ottimale, con un punteggio medio di 2 e un intervallo da 0 a 4 sulla scala di disagio precedentemente descritta. Nessun paziente ha segnalato disturbi nella defecazione, cambiamenti nel transito intestinale o una sensazione di ingombro nell’area pelvico-perineale.
La presenza di un distanziatore ha ridotto tutti i parametri dosimetrici, con un vantaggio statisticamente significativo in V30 (19,5% vs 32,6%, p<0,001), V57 (5,0% vs 12,4%, p<0,001), V60 (2,2% vs 4,5%, p<0,001) e dose rettale media (1781 cGy vs 2294 cGy, p=0,005) nel gruppo con distanziatore e nel gruppo senza distanziatore, rispettivamente (Tabella 1).
Nel complesso, l’impianto di distanziatori si è dimostrato sicuro e rapido, con tollerabilità ottimale del dispositivo. Non sono state osservate complicazioni gravi nel periodo post-procedurale (T0), consentendo l’esecuzione della procedura in regime ambulatoriale. Sono state documentate complicanze lievi legate alla procedura di impianto, ma sono relativamente rare. Abbiamo registrato un episodio di ritenzione urinaria acuta (AUR) in un paziente con una importante ipertrofia prostatica, un fattore di rischio comunemente associato a AUR anche durante le normali procedure di biopsia prostatica.
L’incidenza delle UTI è paragonabile a quella delle biopsie prostatiche transperineali; quindi, si raccomanda di seguire le linee guida più recenti. Anche tra i casi più sfavorevoli (pazienti che hanno già ricevuto un trattamento radiante e necessitano di un altro ciclo di IMRT), non sono state segnalate complicanze. La nostra esperienza complessiva è in linea con il consenso europeo, poiché non abbiamo riscontrato complicazioni acute o ritardate di grado medio-alto, nonostante avessimo una modesta esperienza precedente con questi tipi di dispositivi e procedure transperineali. C
iò evidenzia la bassa curva di apprendimento per questa procedura. I risultati dei nostri dati dosimetrici hanno evidenziato un significativo miglioramento della dosimetria rettale nei pazienti trattati con il distanziatore rispetto al gruppo di controllo senza distanziatore. In particolare, abbiamo osservato una riduzione statisticamente significativa nei parametri dosimetrici V30, V57 e V60 nel gruppo con distanziatore, indicando una minore esposizione del retto alla radiazione. Questo è un risultato importante, in quanto una minore dose di radiazione al retto può contribuire a ridurre il rischio di sviluppare effetti collaterali rettali durante e dopo il trattamento radioterapico.
I distanziatori a palloncino biodegradabile sembrano essere sicuri e ben tollerati e il loro posizionamento non presenta difficoltà tecniche o rischi di complicanze maggiori. Il loro utilizzo può e dovrebbe essere discusso prima del trattamento radiante nei pazienti in cui non vengono rispettati i dose-constraints normalmente validati o nei pazienti suscettibili di reirradiazione. Il dispositivo è progettato per essere lasciato in sede in quanto è biodegradabile e non richiede alcuna manutenzione o monitoraggio aggiuntivo. Ci sono diversi potenziali benefici nell’uso di un distanziatore a palloncino biodegradabile nel trattamento del cancro alla prostata.
Oltre a migliorare potenzialmente l’efficacia della radioterapia, potrebbe anche ridurre il rischio di effetti collaterali come sanguinamento rettale e disagio rettale. Potrebbe anche contribuire a ridurre il rischio di complicanze a lungo termine come incontinenza fecale e urinaria. Nel complesso, i distanziatori a palloncino biodegradabile sono uno strumento promettente, offrendo il potenziale per risultati migliori della radioterapia nei pazienti con tumore prostatico e minori effetti collaterali.