

La qualità e l’aspettativa di vita nei pazienti talassemici trasfusione dipendenti sono significativamente e costantemente migliorate con l’introduzione della terapia ferrochelante che permette la rimozione del ferro trasfusionale, principale responsabile delle complicanze d’organo. Le varie coorti di nascita di pazienti talassemici successive agli anni ’60 dimostrano come la sopravvivenza attuale possa raggiungere, in soggetti aderenti alle cure, la sesta decade di vita e, in prospettiva, quella della popolazione generale che vive altre morbilità (1). Tuttavia, nonostante il progressivo miglioramento delle terapie, le complicanze cardiache rappresentano ancora oggi la maggior causa di morbilità e la principale causa di mortalità nei pazienti talassemici. Il danno miocardico è multifattoriale, determinato dall’emolisi cronica associata a vascolopatia endoteliale infiammatoria, dalla condizione anemica che causa un aumento della gittata cardiaca e dall’accumulo di ferro nei cardiomiociti, prevalentemente attraverso i canali del calcio, che rappresenta il principale responsabile delle alterazioni funzionali cardiache (2). Cronologicamente l’accumulo cardiaco è successivo e conseguente a quello epatico in quanto si manifesta quando i meccanismi di storage epatocitario si sono saturati ed inizia quello miocardico (3-5). La cardiomiopatia finisce poi per determinare dilatazione del ventricolo sinistro con disfunzione sistolica e riduzione della frazione di eiezione. Prima dell’attuale disponibilità di strumenti non invasivi per documentare l’accumulo d’organo, si ipotizzava un sovraccarico miocardico, senza poterlo quantificare, solo sulla base di alterazioni funzionali già evidenti o di uno scompenso in atto. Poter diagnosticare il sovraccarico di ferro, come attualmente possibile con metodiche di risonanza magnetica in fase presintomatica, ci permette di monitorare, personalizzare e intensificare la chelazione con evidenti risvolti positivi sulla qualità ed aspettativa di vita dei pazienti realizzando una vera profilassi dell’accumulo miocardico (6,7).
Si descrive il caso clinico di un paziente talassemico major, maschio di anni 31, trasfusione dipendente dal primo anno di vita. Splenectomia a 7 anni. Epatopatia post trasfusionale HCV correlata, genotipo 4. Falliti due trattamenti con ribavirina/interferone nel 2011 e con sofosbuvir/simeprevir nel 2015. Eradicazione ottenuta con ledipasvir/sofosbuvir nel 2016, con clearance virale completa che persiste ad oggi, ma con esiti in cirrosi epatica postepatitica. Ultimo fibroscan: 33,8 kPa. Paziente monitorato per rischio di HCC. Scarsissima compliance alla ferrochelazione fin dall’età pediatrica, con valori di ferritina persistentemente elevati (tra 2500-3000 ng/ml). Le prime valutazioni strumentali di accumulo dimostravano allo SQUID una LIC di 4,9 Fe/g ldw (2012) e in RMN una T2* cardiaca di 11 ms (nel 2012). Sulla base di questi dati veniva chiesta al paziente una migliore compliance alla terapia, peraltro mai ottenuta, che ha portato ad un progressivo peggioramento (3/2017) dell’accumulo epatico e cardiaco con LIC di 14,4 Fe/g ldw e T2* cardiaca di 7 ms con funzione sistolica VS lievemente depressa (FE 52%). Si osservava anche un progressivo e costante incremento dei livelli di ferritina fino a 4450 ng/ml (3/2017). Si giunse quindi ad un ricovero in urgenza (10/4/2017) per dolore al giugulo, dispnea per lievi sforzi, edemi agli arti inferiori e grave scompenso cardiaco in atto. Incremento degli enzimi di miocardionecrosi (picco TNI 1,36 ng/ml) ed un VS gravemente ipocinetico con severa disfunzione ventricolare (FE in acuto 5%), insufficienza mitralica e tricuspidale associata a disfunzione destra da dilatazione. Subentranti episodi di tachiaritmie atriali (FA ad elevata risposta ventricolare) e TV non sostenute. Nonostante la terapia antiaritmica con amiodarone il paziente rimane in FA anche dopo cardioversione elettrica. Fin dall’inizio della terapia cardiologica si è iniziata chelazione intensiva continua con Deferoxamina (DFO) 30 mg/kg/die in i.c./24 ore associata a Deferiprone (DFP) 90 mg/kg/die p.o. in tre somministrazioni. Successivo sviluppo di severa ipotensione sistemica in un quadro di shock cardiogeno (picco di BNP 4878 pg/ml); circolo sostenuto da adrenalina (0,04 gamma/kg/min) e noradrenalina (0,1 gamma/kg/min) e terapia diuretica. Si posiziona contropulsatore aortico e successivo trasferimento in terapia intensiva rianimatoria. Trattato con CPAP per distress respiratorio da sovraccarico e inizio di terapia dialitica per oligoanuria. Durante questa fase, che ha motivato il trattamento dialitico, è stato temporaneamente sospeso (per 10 giorni) il DFP: sospensione motivata dalla farmacocinetica del farmaco, che in condizioni normali si elimina per via urinaria, non avendo certezza che il complesso chelante-ferro sia rimosso dal trattamento dialitico e possa andare in accumulo di circolo. In tale intervallo è stata mantenuta la chelazione con DFO in infusione continua e successivamente, a diuresi ristabilita, è stata ripresa la terapia combinata con DFP. Pressione arteriosa sempre sostenuta da IABP contropulsazione 1:1 e inotropi. Dopo una settimana lieve miglioramento dell’emodinamica: VS dilatato con VTD 240 ml TAPSE 10 mm, FE 10%. Ulteriori episodi aritmici trattati con amiodarone in boli. Lento miglioramento della diuresi e della funzione miocardica (FE 15%). Concomitante complicanza infettiva con isolamento in emocoltura di Staphylococcus epidermidis e tampone rettale positivo per Klebsiella pneumonie KCV produttore. Ritorna in unità intensiva cardiologica dopo 15 giorni. Rimozione del contropulsatore dopo 23 giorni e scomparsa degli eventi aritmici con recupero della funzione contrattile. Successivo passaggio a DFO s.c., dopo 32 giorni di infusione venosa, sempre associata a DFP p.o. Inviato in terapia riabilitativa, dopo 37 giorni dallo scompenso, asintomatico con completa risoluzione dell’insufficienza renale ed epatica, in compenso cardiocircolatorio (FE 38%; BNP 283); ferritina in evidente riduzione: 1312 ng/ml. Degenza riabilitativa senza problemi cardiologici, assenza di recidive aritmiche con miglioramento della contrattilità (FE 46%); dimesso dopo 15 giorni con terapia diuretica, beta bloccante e ace-inibitore.
Controlli clinici e strumentali successivi:
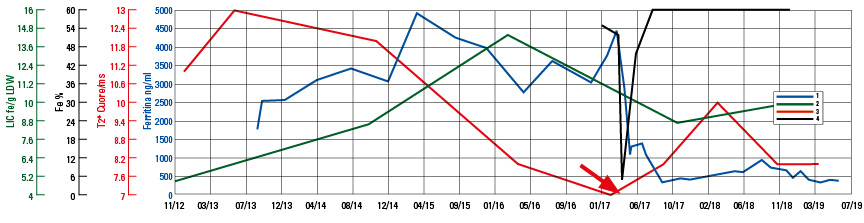
I farmaci ferrochelanti attualmente disponibili, DFO, DFP e Deferasirox (DFX), si sono dimostrati essenziali, in monoterapia, per prevenire e ridurre il sovraccarico marziale corporeo e l’esperienza clinica dimostra la loro sicura efficacia nei soggetti costantemente complianti. In presenza di sovraccarico epatico e cardiaco l’incremento posologico dei singoli chelanti, o meglio, il loro utilizzo in associazione ha da tempo dimostrato l’effetto sinergico degli stessi, che massimizza l’effetto terapeutico (8,9). L’insufficienza ventricolare sinistra rappresenta la principale manifestazione clinica delle complicanze cardiache (3) e oggi abbiamo la possibilità di stimarne l’epoca di insorgenza: valori di T2* cardiaca <10 ms indicano una probabilità del 50% di sviluppare uno scompenso acuto entro un anno (7,8). Regimi di chelazione intensiva combinata con DFO e DFP si sono dimostrati in grado di migliorare la funzione ventricolare nelle siderosi miocardiche severe (9,10,11) e di essere superiori alla singola terapia con DFO; DFX si è dimostrato efficace nel migliorare la T2* cardiaca in pazienti con accumulo miocardico (12). Nello scompenso acuto risulta invece determinante, ai fini del recupero della funzione contrattile ventricolare, associare alla terapia emodinamica di supporto una pronta e costante chelazione intensiva che permetta agli inotropi di agire con efficacia (13,14,15). L’utilizzo di una terapia combinata immediata con DFO e DFP si è dimostrato essenziale per recuperare la funzione contrattile, in un paziente critico, in trattamento con contropulsatore aortico, terapie cardiologiche e rianimatorie intensive. Tuttavia, pur in presenza di un totale recupero clinico e di una normale funzione miocardica, non si è ancora assistito ad un miglioramento della T2* cardiaca che persiste <10 ms. Sappiamo come la clearance miocardica del ferro sia un processo molto lento e spesso siano necessari 3 o più anni in pazienti con grave accumulo, per osservare un miglioramento (9). Inoltre, la compliance certa alla terapia chelante da solo due anni, in un paziente con pregressa HCV, fibrosi epatica severa e cirrosi compensata, può contribuire ad interpretare la persistenza dell’accumulo cardiaco pur con una funzione miocardica recuperata (16). Ancora, l’attuale trend della ferritina, con valori costantemente inferiori a 500 ng/ml, protegge il paziente dalla condizione di massivo sovraccarico che lo ha portato allo scompenso acuto.