
![]()
Farmaci “originali” e “generici”: impatto delle differenze tra gli eccipienti
Prof. Francesco Vittorio Costa, Università di Bologna.
L’introduzione in commercio dei generici, conseguenza della scadenza dei brevetti di molti farmaci “brand” di consolidata esperienza, ha posto il medico di fronte a nuove e delicate problematiche prescrittive.
Tra queste ultime, una delle più significative riguarda la sostituibilità tra farmaci brand e generici: essi sono teoricamente simili come attività terapeutica, ma in realtà presentano delle differenze dal punto di vista della formulazione farmaceutica e in particolare per quanto attiene alla composizione in eccipienti.
Va ricordato a tale proposito che le normative Italiane vigenti stabiliscono che i medicinali generici debbano avere “la stessa composizione quali-quantitativa in principi attivi, la stessa forma farmaceutica e le stesse indicazioni terapeutiche”; tuttavia, la legge stabilisce anche che i generici possono avere eccipienti differenti rispetto al farmaco “originale”, purché siano ad esso bioequivalenti (abbiano cioè dimostrato in studi appropriati di avere la stessa biodisponibilità sistemica) (1,2) (Figura 1)
.
Figura 1
Bioequivalenza: esempio di curve concentrazione/tempo
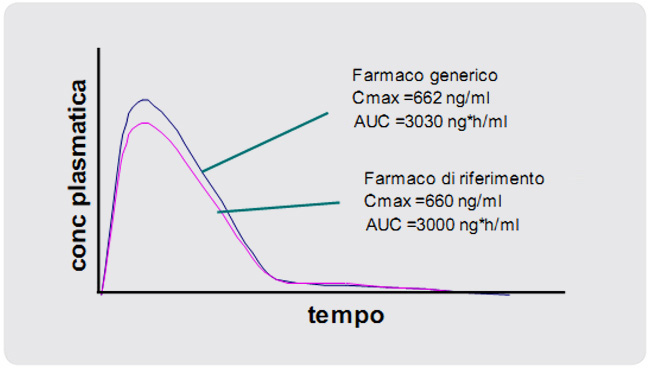
In base alla vigente normativa è quindi possibile che due farmaci, pur essendo tra loro bioequivalenti, possano presentare invece differenze notevoli per quanto riguarda la composizione dei propri eccipienti. Per alcuni farmaci, come ad esempio la ciclosporina, il tipo di eccipienti contenuti nella formulazione può influenzare considerevolmente il profilo farmacocinetico del prodotto (3).
Un ulteriore problema correlato agli eccipienti che può assumere una particolare rilevanza nella pratica clinica, soprattutto per quanto riguarda alcune forme farmaceutiche (ad es. i granulati e le soluzioni orali), è il grado di compliance dei pazienti.
Il tipo di eccipienti contenuti in un granulato, ad esempio, può influenzare significativamente il grado di solubilità in acqua,
e creare difficoltà di compliance, specialmente in pazienti anziani e/o con difficoltà di deglutizione.
Inoltre, non vanno sottovalutati i problemi di allergia o di generica intolleranza ai diversi tipi di eccipiente contenuti nelle formulazioni, soprattutto in considerazione dell’aumentata prevalenza di alcune patologie (ad es. diabete o intolleranza al glutine) che impongono restrizioni alimentari e/o l’evitamento di determinate sostanze.
È possibile, ad esempio, che un medico prescriva un farmaco sotto forma di granulato ad un diabetico in quanto si è accertato che esso non contiene zucchero o altre sostanze nocive a quel particolare paziente; una sostituzione del medicinale, eventualmente effettuata da un farmacista non al corrente della patologia del paziente, potrebbe invece far sì che il paziente assuma un prodotto bioequivalente, ma dolcificato con zucchero, con conseguente rischio di alterazione dell’equilibrio glicemico.
Sono molte le sostanze usate come eccipienti che impongono particolare attenzione: i pazienti affetti da celiachia, ad esempio, devono evitare l’amido di grano (spesso utilizzato come eccipiente di compresse e capsule), mentre quelli affetti da fenilchetonuria devono evitare l’aspartame (4,5).
Un altro problema è legato alla possibilità d’interazione tra eccipienti e farmaco (6). Tale problema può divenire rilevante in soggetti sottoposti a polifarmacoterapia nei quali la sostituzione del farmaco brand col generico può portare a interazioni che non si verificavano col farmaco originale.
In mancanza di una regolamentazione che eviti le problematiche descritte, è quindi comprensibile e giustificabile una certa diffidenza nei confronti dei generici e della sostituzione indifferenziata dei farmaci, senza la consultazione del medico, che è in ogni caso il responsabile della prescrizione. Pertanto, va sempre considerata l’opzione di apporre sulla ricetta la dicitura “non sostituibile”, sinteticamente motivata, per evitare di correre il rischio che eccipienti diversi da quelli presenti nella preparazione che il medico prescrive possano recare disturbi al paziente.
Bibliografia
1. Direttiva europea 2001/83/CE e successive modificazioni, art. 10, comma 5 DLvo n. 219/06; art. 10, comma 2.
2. Dong-Seok Yim. Simulation of the AUC changes after generic substitution in patients. J Korean Med Sci 2009; 24:7-12.
3. Andrisek T. Excipients and their role in absorption: influencing bioavailability of cyclosporine by triglycerides and polyglicerol esters. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2006, 150(2):227–233.
4. Dueñas-Laita A, Pineda F, Armentia A. Hypersensitivity to generic
drugs with soybean oil. N Engl J Med. 2009 Sep 24; 361(13):1317-8.
5. Meredith P. Bioequivalence and other unresolved issues in generic drug substitution. Clin Ther. 2003 Nov; 25(11):2875-90.
6. Crowley P, Martini LG. Drug-excipient interactions. Pharmaceutical Technology Europe, March 2001.
Sommario - Eccipienti: definizioni e caratteristiche
|
Gli eccipienti: caratteristiche generali Con il termine di “eccipienti” si indicano tutte le sostanze utilizzate per favorire la stabilità, la conservazione, la somministrazione e l'assorbimento delle preparazioni farmaceutiche. |
|
N.12/2013 - MedTOPICS - Periodico Quindicinale
È vietata la riproduzione totale o parziale senza il consenso scritto dell'editore - 13T0656
Con il contributo non condizionante di A. Menarini IFR
Copyright © 2013
Colophon | Informazioni legali
