

Il tumore della prostata costituisce la seconda neoplasia maligna più diffusa nel genere maschile (1). Il gold standard per il trattamento della malattia organo-confinata e localmente avanzata è la prostatectomia radicale (2). Tale intervento prevede la rimozione della prostata, con la capsula intatta, delle vescicole seminali e il confezionamento dell’anastomosi uretro-vescicale. In casi in cui è necessario l’intervento prevede anche l’asportazione dei linfonodi iliaco-otturatori bilateralmente (3). L’intervento può essere eseguito in diverse modalità: chirurgia open, chirurgia laparoscopica e chirurgia laparoscopica robot-assistita. Negli ultimi anni quest’ultimo approccio ha sempre più preso piede grazie ai vantaggi offerti dal robot. Negli anni diversi modelli di robot si sono susseguiti nella pratica chirurgica, a partire dai sistemi AESOP e ZEUS, fino ai più recenti “Da Vinci”. Il robot “Da Vinci Xi”, ultimo modello in commercio della Intuitive Surgical, consente una visione in tre dimensioni magnificata fino a dieci volte, un maggior numero di gradi di libertà di movimento rispetto a quelli del polso umano e una correzione automatica (Figura 1) della fisiologica vibrazione durante i movimenti tramite il sistema Endowrist (4).
Figura 1. Intuitive Surgical: Robot Da Vinci modello Xi.
Questi vantaggi consentono una riduzione del tempo operatorio e, grazie ai vantaggi della laparoscopia in genere (minor dolore post-operatorio, minor rischio di emorragia), un ridotto tempo di degenza per il paziente. Tale approccio consente, inoltre, di ridurre le principali complicanze post-procedurali tipiche dell’intervento, ovvero l’incontinenza e la disfunzione erettile. La prostatectomia radicale robot-assistita (RALP) può essere eseguita con diverse tecniche, in questo articolo andremo a studiare gli outcome dei due diversi approcci per l’incisione del collo vescicale, quello postero-laterale e quello anteriore.La prostatectomia radicale video-laparoscopica robot assistita è un intervento che prevede alcuni passaggi chiave. Inizialmente si accede alla cavità peritoneale mediante un accesso open o mediante il posizionamento di un ago di Verres, andando a creare lo pneumoperitoneo. Successivamente vengono posizionati quattro Trocar robotici da 8 mm, un Trocar da 12 mm per l’AirSeal (ovvero il sistema che serve a creare lo pneumoperitoneo) e un Trocar da 5 mm per il chirurgo che servirà da aiuto al tavolo. Successivamente viene posizionato il robot. Nella nostra Unità operativa disponiamo del robot Da Vinci Xi, il quale è dotato di un sistema di puntamento autonomo che consente il corretto posizionamento del robot a seconda della diversa anatomia nella quale il chirurgo dovrà poi lavorare. Una volta che il robot è posizionato il chirurgo alla console procede ad incidere i legamenti ombelicali per accedere allo spazio del Retzius. Si incide, quindi, la fascia endopelvica e successivamente si incide la giunzione vescico-uretrale. Si incide la fascia di Denonviller, identificando le vescicole seminali. Si sezionano i dotti deferenti e i peduncoli vascolari mediante clip metalliche o Hem-o-lok. Si isolano i fasci neurovascolari lateralmente alla prostata, cercando di mantenerli il più possibile integri. Si seziona il plesso di Santorini e si isola l’apice prostatico. Si seziona quindi l’uretra completando la prostatectomia radicale. Si sutura il Plesso di Santorini. Si esegue la ricostruzione del rabdomiosfintere posteriore (Punto di Rocco) (5). Si esegue quindi l’anastomosi del collo vescicale con l’uretra. Questi passaggi, che costituiscono di fatto lo standard dell’intervento, possono in realtà essere eseguiti con diverse varianti. In questo articolo abbiamo confrontato gli outcome clinici degli ultimi 58 pazienti trattati di prostatectomia radicale presso la nostra Unità. Di questi 58 pazienti, 18 sono stati operati da un chirurgo esperto (CDC) il quale effettua un approccio a ore 12 del collo vescicale durante la sua separazione dalla base prostatica, quindi dalla parte anteriore (Figura 2).
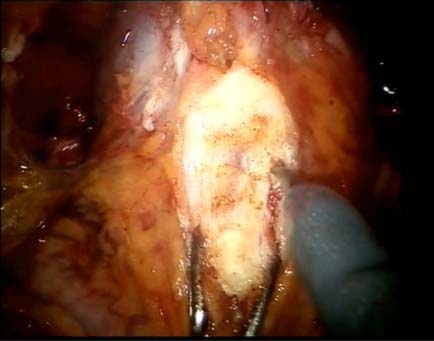
Figura 2. Dissezione anteriore del collo vescicale.
Gli altri 40 pazienti sono stati operati da due chirurghi esperti (SP e FT) i quali invece approcciano il collo vescicale a ore 5 e a ore 7, quindi dalla parte postero-laterale. Questa fase dell’intervento è un momento cruciale, in quanto dalla corretta individuazione del piano vescico-prostatico e dalla sua sezione dipende la continenza del paziente. La corretta sezione del collo vescicale consente, infatti, la corretta anastomosi vescico-uretrale, e permette il mantenimento della funzionalità erettile, in quanto i nervi responsabili dell’erezione decorrono in prossimità della porzione posteriore del collo vescicale. Per questo motivo abbiamo confrontato fra di loro i valori di emoglobina pre e post operatori, la presenza o meno di fistole a livello dell’anastomosi vescico-uretrale al controllo cistografico, l’incidenza di incontinenza alla rimozione del catetere vescicale e la presenza di disfunzione erettile a tre mesi dall’intervento.Dei pazienti presi in esame solamente l’1,7% (1/58) presentava incontinenza prima dell’intervento chirurgico (incontinenza da urgenza). Dopo l’intervento la percentuale di incontinenza da sforzo al momento della rimozione del catetere vescicale è stata dell’11,1% nel gruppo CDC e del 10% nel gruppo SP e FT. La perdita di emoglobina media rispetto al valore iniziale pre-intervento è stata del 8,6% (1,2 g/dl) nel gruppo CDC e del 7,83% (1,1 g/dl) del gruppo SP e FT. Solo l’1,7% (1/58) dei pazienti ha avuto spandimento di mezzo di contrasto alla cistografia retrograda e minzionale (Gruppo SP e FT). La percentuale di disfunzione erettile è stata del 66,6% (12/18) nel gruppo CDC e del 67,5% (27/40) nel gruppo SP e FT. La ripresa della funzione erettile a tre mesi dall’intervento è stata superiore al 65% in entrambi i gruppi analizzati. La degenza media di entrambi i gruppi è stata di tre giorni.
Alla luce dei risultati ottenuti si evince come la nostra esperienza sia sovrapponibile per outcome ai principali articoli presenti in letteratura (6,7). È altresì evidente come anche la differenza fra i due gruppi non sia significativa. Tali dati risultano essere migliori di quelli ottenuti con approccio open per quanto riguarda il tempo di degenza e le perdite ematiche. Questi dati dimostrano, quindi, come la chirurgia robotica sia in grado di ridurre il numero di giorni di degenza e il numero di trasfusioni necessarie a prescindere dal tipo di tecnica utilizzata. I risultati sulla continenza restano anch’essi sovrapponibili a quelli in letteratura, dimostrando come entrambi i nostri approcci non siano inferiori a quelli presenti in letteratura (6). Per quanto riguarda la continenza, tale risultato è da attribuire alla capacità mediante il robot di raggiungere facilmente localizzazioni situate più profondamente e di minori dimensioni, come porzione apicale della prostata. È infatti fondamentale cercare di preservare il più possibile lo sfintere uretrale. Con il robot risulta, inoltre, più facile eseguire la ricostruzione del rabdomiosfintere posteriore grazie alla magnificazione e alla visualizzazione 3D. La disfunzione erettile a tre mesi ha un’incidenza maggiore rispetto all’incontinenza, è una complicanza legata soprattutto alla necessità di radicalità oncologica, per la quale è necessario talvolta sezionare i peduncoli vascolo-nervosi situati latero-posteriormente alla prostata. Se il tumore, infatti, giunge in prossimità della capsula, o, addirittura, oltre la stessa non vi è la possibilità di preservarli. Se invece il tumore è presente in un solo lobo prostatico e presenta caratteristiche di scarsa malignità (es. Gleason 3+3) vi è la possibilità di eseguire una chirurgia cosiddetta “nerve-sparing”. La tecnica “nerve sparing” può essere eseguita sezionando in corrispondenza di un piano intrafasciale, interfasciale o extrafasciale (8). Il maggior numero di nervi viene risparmiato sezionando a livello intrafasciale, viceversa il minor numero sezionando a livello extrafasciale. Anche in questo caso la chirurgia robotica presenta degli enormi vantaggi rispetto alla chirurgia open e laparoscopica. Essa consente infatti di distinguere maggiormente la componente vascolo-nervosa dalla prostata, sempre per merito della magnificazione e della visione tridimensionale, e di conseguenza un migliore outcome clinico.
Figura 3. L’équipe robotica dell’Urologia di Modena (da sinistra a destra): Prof. Salvatore Micali, Dott. Cosimo de Carne, Dott. Stefano Puliatti, Dott. Marco Ticonosco.