
Neonati “late preterm” e rischio di infezione da Virus Respiratorio Sinciziale
In questi ultimi anni è incrementato nei Paesi industrializzati il numero delle nascite pretermine ed in particolare la quota di quelle tra le 34 e le 36 settimane di gestazione (1,2) Ciò è dovuto a svariati fattori, connessi con l’aumento di alcune patologie materne quali l’obesità e l’ipertensione, ad età spesso più avanzate nella procreazione, ad un numero talvolta sconsiderato di tagli cesarei, nonché alla diffusione delle tecniche di procreazione medicalmente assistita (3,4). Fino a pochi anni or sono, i nati con queste età gestazionali, piuttosto prossime al termine, venivano definiti nella letteratura anglosassone “near-term”, o “slightly premature” a sottolineare il concetto di una condizione al limite del fisiologico. Al contrario, in questi ultimi anni è stato rilevato come i neonati pretermine con età gestazionale tra 34 e 36 settimane (meglio definiti come “late preterm”) sono a rischio di una serie di complicanze che possono comportare l’allungamento della degenza, accertamenti laboratoristici e strumentali, nonché frequenti riospedalizzazioni, specie nei primi mesi di vita.
I “late preterm”
I nati “late preterm” costituiscono un subset di prematuri di età gestazionale compresa tra 34/0 e 36/6 settimane (5). Su questa popolazione si è ultimamente focalizzata l’attenzione dei clinici, data l’evidenza di un progressivo aumento della sua quota nell’ambito delle nascite annuali; in particolare, negli USA i dati relativi al 2009 riportano un tasso di nascite “late preterm” pari al 9% (su un totale di nascite premature ≤37 settimane di età gestazionale del 12,7%), con un incremento superiore al 25% nell’ultimo ventennio. Detta coorte di prematuri presenta alla nascita, oltre ad una superiore mortalità, anche tassi più elevati di complicanze (tra cui principalmente instabilità della temperatura corporea, ipoglicemia e distress respiratorio) (6), con conseguente aumentata necessità di ricovero durante il periodo neonatale ed incremento dei costi (7).
Fisiopatologia respiratoria dei “late preterm”
Lo sviluppo dei polmoni si realizza durante tutta la gravidanza e continua nelle prime fasi della vita. Le unità respiratorie terminali polmonari si formano progressivamente, attraverso vari stadi, tra cui gli ultimi sono (8): - sacculare (25-36 settimane di età gestazionale): si osserva un marcato ingrandimento delle vie aeree periferiche con aumento dell’area di scambi gassosi; - alveolare (dopo la 36ª settimana di gestazione e fino ai 2 anni di vita): si assiste allo sviluppo di capillari entro ciascun sacco terminale o alveolo ed al graduale aumento dei livelli di surfactante ai valori dell’adulto. I nati “late preterm”, a causa dell’immaturità strutturale dei propri polmoni, possono andare incontro a complicanze respiratorie dovute a deficit di surfactante e, ipovascolarizzazione con ritenzione di fluidi ed alterazioni degli scambi gassosi respiratori (9). Inoltre la concomitante immaturità del sistema immunitario, sostanzialmente dovuta ad immaturità delle cellule natural killer e dei leucociti, espone tali neonati ad un maggior rischio di infezione sia da Virus Respiratorio Sinciziale (VRS) che da altri patogeni (10). Il sistema immunitario dei “late preterm” appare ulteriormente compromesso dall’incompleto trasferimento di anticorpi materni, poiché è principalmente nelle ultime settimane di gestazione che si realizza un significativo passaggio materno-fetale di anticorpi di tipo IgG (11). In questa stessa popolazione, l’eventuale assenza di alimentazione al seno materno costituisce un ulteriore rischio aggiuntivo, venendo a mancare i benefici immunitari legati al trasferimento con tale modalità di allattamento, sia di IgA, IgG ed IgM, sia di linfociti T e B (11).
Infezione da Virus Respiratorio Sinciziale (VRS)
L’infezione da VRS tende ad essere stagionale, verificandosi generalmente da novembre ad aprile nei Paesi a clima temperato (12) (Figura 1).
FIGURA 1. Analisi della bioequivalenza: un ipotetico studio di bioequivalenza che confronta due preparazioni farmaceutiche dello stesso farmaco.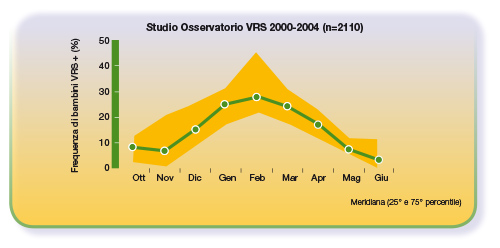 |
La trasmissione avviene attraverso goccioline aerosolizzate liberate in seguito a starnuti o colpi di tosse, nonché per contatto diretto con secrezioni o superfici contaminate; a tal proposito, è stato riportato che il VRS può resistere parecchie ore su alcuni oggetti come i giocattoli e fino a 30 minuti sulle mani o sui vestiti (13). Il Virus Respiratorio Sinciziale (VRS) rende conto dell’80% delle bronchioliti e del 50% delle polmoniti osservate in età pediatrica (14). L’infezione da VRS è causa di mortalità 9 volte superiore all’influenza stagionale nei primi 6 mesi di vita, costituendo la principale causa virale di decesso infantile (15); è dimostrato inoltre, che l’infezione da VRS delle basse vie aeree predispone alla successiva insorgenza di asma e “wheezing” (16). La fisiopatologia dell’infezione da VRS presuppone la replicazione dell’RNA virale nel citoplasma delle cellule epiteliali respiratorie infette. L’ingresso del virus nell’epitelio respiratorio è connesso alle due proteine di superfice G e F, che promuovono, rispettivamente, l’adesione dell’agente patogeno alle cellule ospiti ed il suo passaggio dalle cellule infette a quelle sane adiacenti; questo meccanismo consente una rapida trasmissione “cellula a cellula” del VRS con formazione di grossi elementi sinciziali multinucleati, da cui il nome del virus. La rapida fusione e distruzione delle cellule epiteliali ciliate causa accumulo di muco e detriti cellulari, edema e broncocostrizione caratteristici dell’infezione da VRS; i tappi mucosi possono ostruire completamente i bronchioli terminali ed estendersi agli alveoli (17). L’ingresso del virus nell’organismo si realizza attraverso le mucose orale, nasale e congiuntivale ed il periodo di incubazione varia da 2 a 8 giorni. L’infezione da VRS generalmente non comporta compromissione di altri apparati al di fuori dell’apparato respiratorio. Nei nati a termine, la maggior parte dei casi di infezione da VRS è limitata alle alte vie aeree con un quadro clinico simile al raffreddore comune. I segni/sintomi dell’infezione iniziano tipicamente da 4 a 6 giorni dal contatto iniziale con l’agente patogeno ed includono rinorrea, congestione nasale e tosse. Tuttavia l’infezione può diffondere al tratto respiratorio inferiore, determinando distress respiratorio di grado lieve, moderato o severo; la malattia lieve-moderata si caratterizza per febbricola, rinorrea, tosse, otite, tachipnea moderata, irritabilità ed inappetenza, mentre le forme severe di infezione comportano tachipnea, tachicardia, cianosi, wheezing, tosse, rientramenti intercostali. Gli alterati scambi respiratori possono condurre ad un marcato scadimento delle condizioni del neonato con ipossia, aumentato sforzo respiratorio, ridotta capacità di alimentazione e disidratazione (18). In un ospite con una riduzione dell’immunità, come il neonato “late preterm”, l’infezione si diffonde frequentemente al tratto respiratorio inferiore, determinando i sintomi tipici di un’infezione delle basse vie aeree, manifestandosi più spesso come bronchiolite e richiedendo più frequentemente l’ospedalizzazione (19,20,21). L’elemento essenziale per la diagnosi è l’esame fisico integrato, solo se necessario, da radiografia del torace e da indagini di laboratorio; la presenza di antigeni di VRS nelle secrezioni respiratorie può essere svelata mediante tecniche di diagnostica rapida quali l’immunofluorescenza o il dosaggio immunoenzimatico. Utile ai fini della condotta terapeutica è la rilevazione della saturazione di O2 del paziente, mediante pulsiossimetria (14).
Distress respiratorio ed infezione da VRS nei “late preterm”
Il distress respiratorio rappresenta la complicanza più temibile dell’infezione da VRS. Nei nati “late preterm”; tale complicanza varia dal 3,6% al 28,9% contro tassi di 0,6%-4,2% riportati nei nati a termine (22).
Per la valutazione del quadro clinico è utile rilevare la frequenza respiratoria (un valore >70 atti/minuto indica un quadro che richiede osservazione ospedaliera), la gravità del distress respiratorio, definito dall’intensità dell’eventuale wheezing e dalla presenza di rientramenti inspiratori. Va inoltre monitorata la saturazione in O2 periferica transcutanea, che se inferiore a 92% deve comportare il ricovero, nonché la capacità di assumere liquidi, l’eventuale presenza di letargia, la comparsa di apnee. È utile inoltre valutare la capacità della famiglia di gestire a domicilio il piccolo.
Le strategie terapeutiche da utilizzare nel trattamento dell’infezione da VRS dipendono dalla gravità del quadro clinico, con misure di supporto che richiedono la semplice somministrazione di ossigeno riscaldato ed umidificato e la reidratazione, fino all’intubazione ed alla ventilazione meccanica in presenza di insufficienza respiratoria grave e/o apnee subentranti. I punti cardine del trattamento dell’infezione da VRS nei nati “late preterm” vengono riportati in tabella 1 (22).
TABELLA 1. Misure di supporto per il trattamento dei nati “late preterm” con infezione da VRS (22)  |
Riguardo al trattamento farmacologico della bronchiolite da VRS nei nati “late preterm”, le linee guida dell’American Academy of Pediatrics (23) sottolineano i seguenti aspetti:
- La ribavirina non è raccomandata come trattamento antivirale di routine sebbene si sia dimostrata in grado di ridurre la durata della ventilazione meccanica ed i giorni di ospedalizzazione nei pazienti critici. Mancando di un’evidenza provvista di adeguato potere statistico della sua efficacia in tale indicazione, attualmente gli esperti concordano che il suo impiego venga riservato ai soli pazienti con gravità della bronchiolite tale da costituire una minaccia per la vita (17,24).
- I broncodilatatori possono essere presi in considerazione nei bambini con bronchiolite di grado lieve-moderato. La loro efficacia, peraltro limitata dal ridotto calibro delle vie aeree dei pazienti trattati e dalla scarsa rappresentazione della muscolatura liscia, va monitorata con attenzione ed il loro impiego terapeutico proseguito solo in presenza di miglioramento del quadro clinico (19).
- I corticosteroidi hanno dimostrato di comportare benefici scarsi o addirittura assenti nel trattamento dei neonati con bronchiolite da VRS, per cui non sono raccomandati (24). - Gli antibiotici sono indicati solo se vi è rischio elevato di sovrainfezione batterica o forte sospetto clinico-laboratoristico (14).
Distress respiratorio ed infezione da VRS nei “late preterm”
In considerazione della stagionalità della circolazione del VRS (che nelle nostre realtà generalmente va da novembre ad aprile) e delle modalità di diffusione dell’infezione, è strategico attuare tutte quelle norme di profilassi ambientale, che possono drasticamente ridurne la diffusione in ambito domestico ed ancor più ospedaliero (22) (Tabella 2).
TABELLA 2. Norme di profilassi ambientale per limitare la diffusione del VRS |
Tutti i neonati ad alto rischio di ospedalizzazione per infezione da VRS vanno inoltre valutati per definire se soddisfino i criteri identificati da numerose società scientifiche, tra le quali la Società Italiana di Neonatologia (SIN), per la profilassi con palivizumab. Il palivizumab è un anticorpo monoclonale umanizzato che, somministrato mensilmente per la durata del periodo epidemico per via intramuscolare, agisce legandosi alla proteina F del virus in modo sicuro ed efficace, riducendo l’impatto dell’infezione sostenuta da tale patogeno e dunque le ospedalizzazioni (23).
Programma di profilassi con palivizumab nei neonati ad alto rischio per infezione da VRS: le nuove linee guida
Il tasso annuo di ospedalizzazione per infezione da VRS nei soggetti pediatrici appartenenti a gruppi ad alto rischio, non sottoposti ad immunoprofilassi con palivizumab è del 10%-15%, ossia 5 volte maggiore di quello dei neonati non ad alto rischio (25). I risultati di due trial randomizzati controllati, condotti su un’ampia popolazione (n=2789) di neonati e bambini con prematurità, pneumopatia cronica e/o cardiopatia congenita sottoposti a profilassi con palivizumab, hanno dimostrato un significativo abbattimento delle percentuali di ricovero dovuto all’infezione da VRS, variabile dal 39% al 78% nei diversi gruppi considerati (25). Recentemente sono state pubblicate le linee guida aggiornate dell’American Academy of Pediatrics (26) concernenti la profilassi dell’infezione da VRS con palivizumab. Rispetto alle precedenti raccomandazioni della stessa società scientifica americana del 2006, sono rimaste sostanzialmente invariate le raccomandazioni riguardanti i prematuri con cardiopatia congenita e malattia polmonare cronica e/o nati prima di 32 settimane e 0 giorni di età gestazionale, mentre sono state introdotte importanti modifiche per quanto attiene la profilassi nei neonati di età gestazionale compresa tra questa e 34 settimane 6 giorni senza pneumopatia cronica o cardiopatia congenita emodinamicamente significativa (25). Nell’ambito di questa popolazione, viene suggerita la somministrazione di palivizumab durante il periodo di diffusione del VRS se è presente almeno uno dei seguenti fattori di rischio aggiuntivo, rappresentati dall’inserimento del bambino in strutture quali asili nido e dalla convivenza con 1 o più fratelli o con altri bambini di età inferiore a 5 anni. In questi neonati, viene raccomandata la somministrazione di palivizumab per un massimo di 3 dosi mensili, fino al raggiungimento dei 3 mesi di età (26).
Alcune riflessioni sulle nuove linee guida dell’AAP
Le modificazioni proposte dall’AAP per i nati con età gestazionale compresa tra le 32 e le 35 settimane si prefiggono di ottimizzare il rapporto costo-beneficio derivante dalla profilassi con palivizumab (27). Esse derivano “in primis” da considerazioni epidemiologiche circa la diffusione stagionale del VRS nelle eterogenee realtà americane: tuttavia indicazioni differenti sono ad esempio fornite per lo stato della Florida, che ha clima assolutamente diverso da quello di molti altri stati USA. La realtà epidemiologica italiana, pur con andamento non perfettamente prevedibile da anno ad anno, è stata ben identificata dalle rilevazioni effettuate dallo studio nazionale “Osservatorio VRS”, condotto per 4 stagioni epidemiche consecutive (2000-2004), che ha identificato l’inizio della stagione epidemica a novembre ed il suo termine ad aprile, con picchi di massima incidenza tra gennaio e febbraio. In base a ciò, la profilassi con palivizumab attualmente suggerita dalla Società Italiana di Neonatologia prevede la somministrazione mensile del farmaco per tutto il periodo epidemico, fino ad un massimo di 5 dosi (27). Applicando le attuali indicazioni dell’ AAP, che prevedono la somministrazione di un massimo di 3 dosi, fino al compimento del terzo mese di età, un numero considerevole di bambini di queste età gestazionali resterebbero, nelle nostre realtà, senza “copertura” non solo nei mesi epidemici, ma addirittura in quelli di massima circolazione virale (ad esempio quelli nati in settembre sospenderebbero la profilassi in dicembre!) (27). Va sottolineato inoltre che, mentre è stata dimostrata una riduzione del 50% del rischio relativo di ospedalizzazione nei neonati che hanno ricevuto il regime di immunoprofilassi con 5 dosi di palivizumab, nessuno studio ha valutato l’efficacia dello schema a 3 dosi (27). Riguardo ai 2 fattori di rischio considerati dall’AAP per indirizzare la profilassi, vi è consenso unanime che siano tra quelli maggiormente predittivi di rischio di ospedalizzazione per infezione da VRS. Tuttavia numerosi studi, nazionali ed internazionali, hanno evidenziato tutta una serie di altre condizioni dimostratesi capaci di aumentare il rischio di ospedalizzazione per infezione da VRS quali, ad es., il sesso maschile, la mancanza di allattamento al seno, il basso peso alla nascita, la familiarità per wheezing e atopia, l’ambiente familiare sovraffollato ed il fumo passivo. In base a questi fattori di rischio, ove sia stata attuata la profilassi, si è assistito ad un buon rapporto costo-efficacia (28).
|