


Newsletter Maggio 2019
In questo numero sono stati selezionati due studi che hanno valutato l’utilità della PET con traccianti per la β-amiloide e della PET con [18F] -FDG nell’iter diagnostico-terapeutico di pazienti con vari tipi di deficit cognitivi; i lavori sono stati pubblicati, rispettivamente su Journal of Alzheimer’s Disease (2018)(1) e su European Journal of Nuclear Medicine and Molecular Imaging (2019)(2).
1) Shea YF et al. Utility of Amyloid PET Scans in the Evaluation of Patients Presenting with Diverse Cognitive Complaints. J Alzheimer's Dis. 2018;66(4):1599-1608. doi: 10.3233/JAD-180683.L’UTILITÀ DELL’IMAGING PET-AMILOIDE NELLA VALUTAZIONE DI PAZIENTI CON VARI DISTURBI COGNITIVI
Shea YF et al. Utility of Amyloid PET Scans in the Evaluation of Patients Presenting with Diverse Cognitive Complaints. J Alzheimer's Dis. 2018;66(4):1599-1608Limiti della diagnosi clinica di Malattia di Alzheimer e Criteri AUC
La malattia di Alzheimer (AD) è la causa più frequente di disturbi cognitivi maggiori e rappresenta più del 60% di tutte le demenze.
Formulare una precoce e corretta diagnosi differenziale di demenza è molto importante dal punto di vista terapeutico e prognostico. Tuttavia la diagnosi clinica presenta un’accuratezza limitata: è stato infatti dimostrato che la diagnosi clinica di probabile AD ha una sensibilità e una specificità pari rispettivamente al 70.9% e 70.8%.
Sono stati pubblicati diversi studi sull’impatto della PET-amiloide cerebrale sulla diagnosi e sulla gestione dei pazienti con disturbi cognitivi. È emerso così che questa indagine strumentale è in grado di modificare la diagnosi (dal 9% al 69% dei casi, a seconda delle varie casistiche pubblicate), di modificare la prescrizione (o la sospensione) di farmaci specifici per la AD o di farmaci per il trattamento di disturbi psichiatrici correlati (dal 25.4% all’81.3% dei casi). Nonostante queste evidenze, l’esperienza relativa all’impatto della PET-amiloide nella normale pratica clinica (real world) è tuttora relativamente limitata.
Di recente sono stati pubblicati i criteri per l’impiego appropriato dell’imaging PET-amiloide cerebrale nella valutazione dei disturbi cognitivi (criteri AUC), al fine di ottimizzare l’utilizzo di questa metodica (Johnson KA et al. 2013). Secondo tali criteri, i pazienti idonei per lo studio mediante imaging PET-amiloide sono:
1) Pazienti con inspiegabile decadimento cognitivo lieve persistente o progressivo (MCI).
2) Pazienti che soddisfano i criteri clinici di possibile AD, ma con dubbia presentazione clinica o con decorso clinico atipico o con presentazione che prospetti un’eziologia mista.
3) Pazienti con demenza progressiva e con età di insorgenza atipicamente precoce (prima dei 65 anni).
I Medici che operano nelle strutture specialistiche che si occupano dei disturbi cognitivi visitano più spesso pazienti che rientrano nel secondo dei suddetti criteri, ovvero pazienti in cui la diagnosi di AD è possibile ma non certa, a causa di un quadro clinico non univoco, di un decorso atipico o di indizi clinici che rimandano ad un mix di eziologie.
Questi casi presentano un range di possibili eziologie diverse alla base del deficit cognitivo e di frequente presentano diverse comorbidità internistiche e psichiatriche, in trattamento con vari farmaci, che di per sé contribuiscono a rendere meno agevole la diagnosi.
Lo scopo dello studio pubblicato da Shea et al. nel 2018 è stato quello di valutare l’impatto della PET-amiloide sulla diagnosi e sulla gestione (management) generale di pazienti che rientravano in uno dei tre criteri specifici AUC sopra esposti.
Un ulteriore obiettivo della ricerca - mai indagato in studi precedenti - è stato quello di valutare l’impatto addizionale della PET-amiloide su diagnosi e gestione di pazienti per i quali la RM (Risonanza Magnetica) aveva orientato la diagnosi verso AD o non-AD.
Valutazione dell’impatto della PET-amiloide
L’impatto della PET-amiloide è stato valutato in base ai cambi della diagnosi e/o del management intervenuti in seguito all’utilizzo dell’indagine. Il cambio di diagnosi è stato definito come qualunque cambio della diagnosi eziologica formulata presso il centro di terzo livello rispetto a quella del centro di secondo livello (es. diagnosi di AD vs non-AD o di MCI-AD vs MCI- non-AD).
I cambi della gestione sono stati classificati come:
1) inizio di un nuovo trattamento farmacologico o sospensione di un trattamento in corso;
2) aggiustamento dei trattamenti in atto;
3) prescrizione di ulteriori test diagnostici;
4) riesposizione o ridiscussione dei risultati dei test, della diagnosi, della prognosi e del rischio di demenza nei familiari;
5) raccomandazioni sulle modifiche dello stile di vita (attività fisica, dieta, attività sociali e cognitive, igiene dentale e generale) e consigli su misure di sicurezza.
Impatto della PET-amiloide su diagnosi e management
Tra i 102 pazienti selezionati in questo studio, 62 pazienti (60.8%) hanno riportato una PET positiva per l’amiloide (A+), mentre 40 pazienti (39.2%) hanno riportato una PET con amiloide negativa (A–).
Tutti i pazienti sono stati sottoposti a RM precedentemente alla PET-amiloide. I pazienti che presentavano caratteristiche RM indicative di AD, sono risultati più frequentemente amiloide positivi (A+) rispetto a quelli con caratteristiche alla RM non indicative di AD (66.2% versus 33.8%; χ2 = 4.50, p = 0.04).
I cambi di trattamenti specifici per AD post-PET si sono verificati nel 26.5% dei pazienti studiati. Cambi significativi del management generale del paziente (aggiunta di nuovi farmaci, sospensioni di trattamenti farmacologici in corso, prescrizione di altri test diagnostici, consigli sulle attività quotidiane e su sicurezza o una combinazione dei precedenti) sono stati riportati nel 59.8% dei pazienti (Tabella 1).
Tabella 1. Cambio del management post-PET amiloide nei diversi sottogruppi di pazienti.
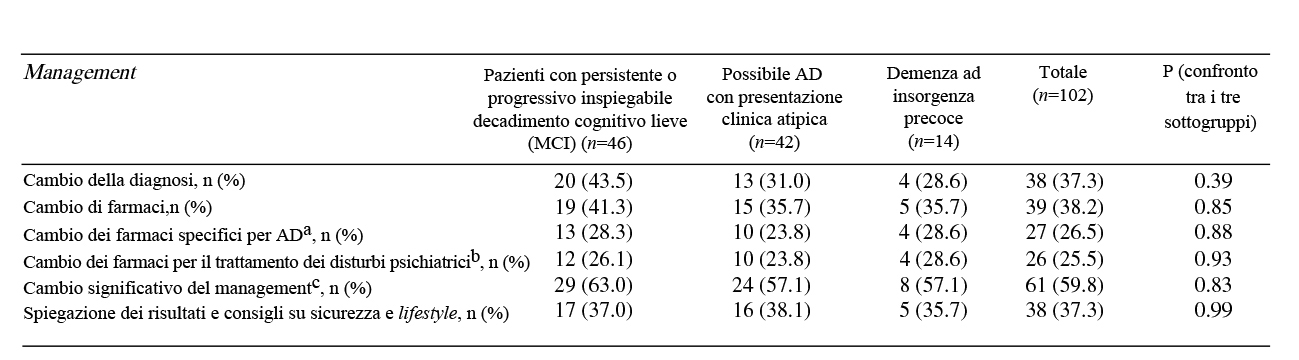
Non sono emerse differenze nell’impatto dei risultati della scansione PET-amiloide tra i pazienti raggruppati in base ai tre differenti criteri AUC.
Tuttavia, l’impatto della PET è stato maggiore tra i pazienti che avevano una diagnosi iniziale di non-AD rispetto a quelli con diagnosi iniziale di AD prima della PET: 44.4% dei pazienti non-AD ha avuto un cambio della diagnosi (in AD) dopo la PET, mentre solo il 31.8% dei pazienti con diagnosi di AD ha avuto un cambio (in non-AD) dopo la PET (χ2 = 5.46, p = 0.02).
Risultati
In questo studio tutti i pazienti rientravano in uno dei criteri AUC; la PET-amiloide era positiva nel 60.8% di essi (A+) e ha influenzato la diagnosi, determinandone un cambio nel 37% e inducendo anche significativi cambi nel management del 60% dei pazienti.
Secondo i dati qui riportati, la probabilità che un caso inizialmente diagnosticato come demenza non AD avesse un cambio di diagnosi post-PET era maggiore rispetto alla probabilità del cambio inverso (ovvero da AD a non-AD).
Tra i pazienti con diagnosi di AD prima della PET, tutti quelli (n=7) con caratteristiche atipiche hanno avuto un cambio di diagnosi (da AD a non-AD) dopo la PET.
Conclusioni
Questo studio ha dimostrato che la PET-amiloide ha un impatto significativo sulla diagnosi e sul management dei pazienti con disturbi cognitivi, specie nel sottogruppo di pazienti negativi alla PET con amiloide (A-).
I risultati qui riportati sono stati ottenuti in una coorte di pazienti relativamente non selezionata e che afferiva ad un centro specialistico presentando deficit cognitivi ad eziologia multipla.
La presenza di caratteristiche tipiche di AD alla RM è risultata associata con una più alta probabilità di positività alla PET (A+). Tuttavia, l’impatto sulla diagnosi e sul management è risultato massimo per i pazienti negativi alla PET (A-), per quelli con caratteristiche atipiche e per quelli con diagnosi di non-AD, in particolare i casi con caratteristiche RM suggestive di AD.
RUOLO DI PET CEREBRALE CON [18F ]-FDG E PET-AMILOIDE NELLA DIAGNOSI DIFFERENZIALE DELLE DEMENZE
Hellwig S et al. Amyloid imaging for differential diagnosis of dementia: incremental value compared to clinical diagnosis and [18]FDG PET. Eur J Nucl Med Mol Imaging. 2019 Feb;46(2):312-323.Introduzione
La PET cerebrale può essere impiegata per migliorare l’accuratezza diagnostica delle demenze. In particolare, la PET con [18F]-FDG è utile per evidenziare la degenerazione neuronale, mentre la PET amiloide è in grado di evidenziare la presenza di placche di beta-amiloide a livello cerebrale; questo elemento caratteristico è notoriamente correlato alla Malattia di Alzheimer (AD).
Sulla base di tali premesse, le Linee guida del National Institute on Aging-Alzheimer's Association (McKhann GM et al. Alzheimers Dement. 2011; 7:263 –9) hanno raccomandato una valutazione combinata con questi due traccianti per la PET per migliorare l’accuratezza della diagnosi clinica delle demenze.
Dall’analisi dei vari studi pubblicati emerge che la presenza (o l’assenza) di placche di amiloide in un paziente con deficit cognitivo risulta dirimente in caso di dubbio diagnostico emerso dal solo esame clinico e PET con [18F]-FDG.
Il presente studio ha inteso valutare il possibile contributo della PET amiloide nel migliorare l’accuratezza della diagnosi differenziale delle demenze rispetto ad una diagnosi esclusivamente clinica e rispetto alla diagnosi clinica più PET con FDG, in una popolazione di pazienti con deficit cognitivo.
Il disegno dello studio
Gli 84 pazienti inclusi nello studio erano tutti affetti da disturbo neurocognitivo maggiore (secondo DSM-5). La Figura 1 riporta la flow-chart dei pazienti arruolati.
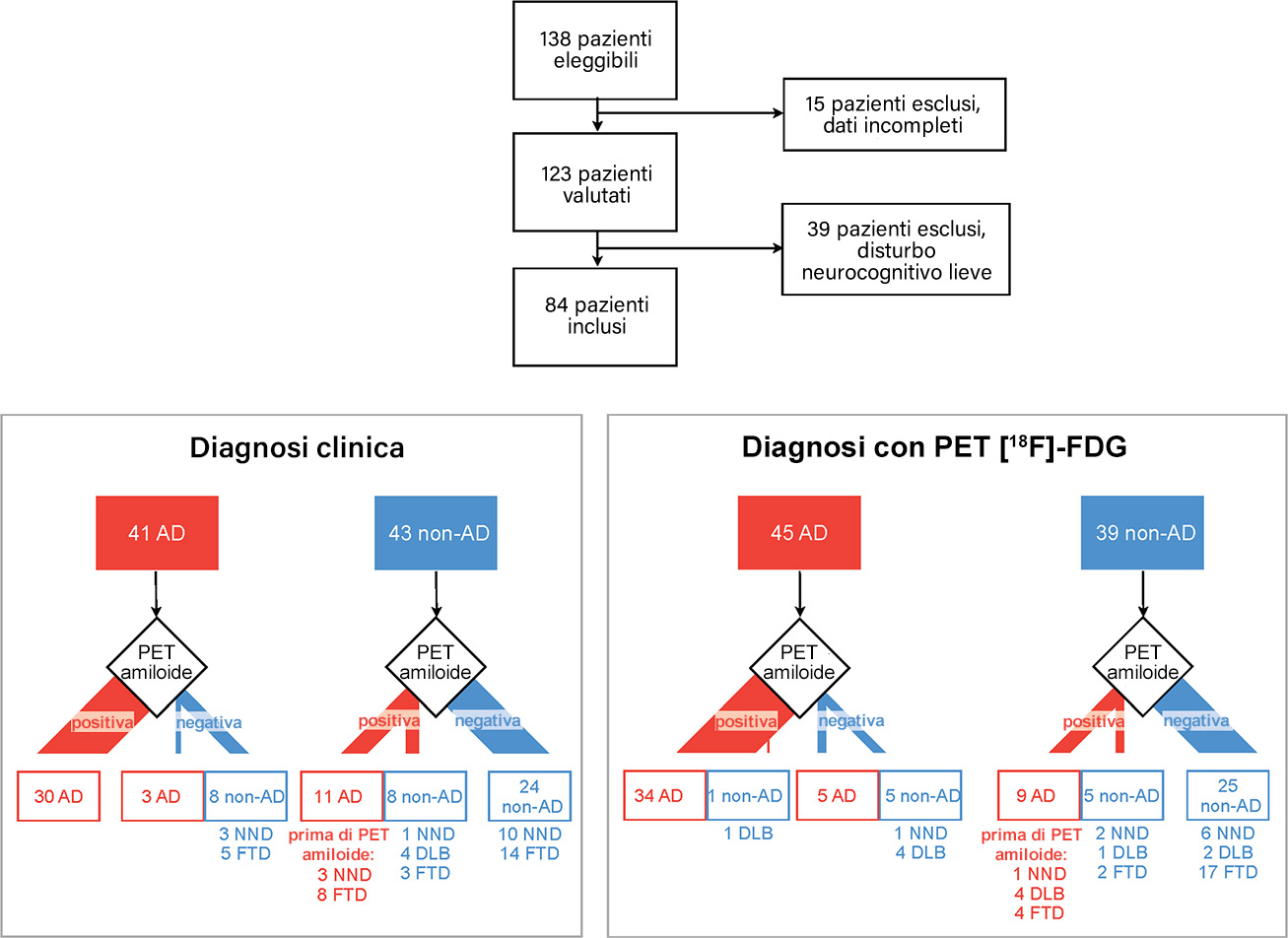
Tutti gli 84 pazienti con disturbo neurocognitivo maggiore inclusi nello studio sono stati classificati come affetti da demenza di Alzheimer (AD, rettangoli rossi) o non-Alzheimer (non-AD, rettangoli blu) in base alla diagnosi clinica iniziale (riquadro inferiore sinistro) o con PET [18F]-FDG (riquadro inferiore destro).
Tutti i pazienti sono stati sottoposti a PET amiloide e nel grafico sono mostrati i cambi della diagnosi iniziale (clinica e per imaging molecolare) dopo l’analisi dei risultati di tale indagine. Il gruppo non-AD include pazienti con demenza fronto-temporale (FTD), demenza a corpi di Lewy (DLB) e con deterioramento cognitivo non causato da neurodegenerazione (NND).
(riprodotta da Figura 1 di Hellwig S et al. Amyloid imaging for differential diagnosis of dementia: incremental value compared to clinical diagnosis and [18F]-FDG PET. Eur J Nucl Med Mol Imaging. 2019 Feb;46(2):312-323)
RISULTATI DELLO STUDIO
Cambi di diagnosi e concordanza tra diagnosi con PET amiloide e con PET [18F]-FDG
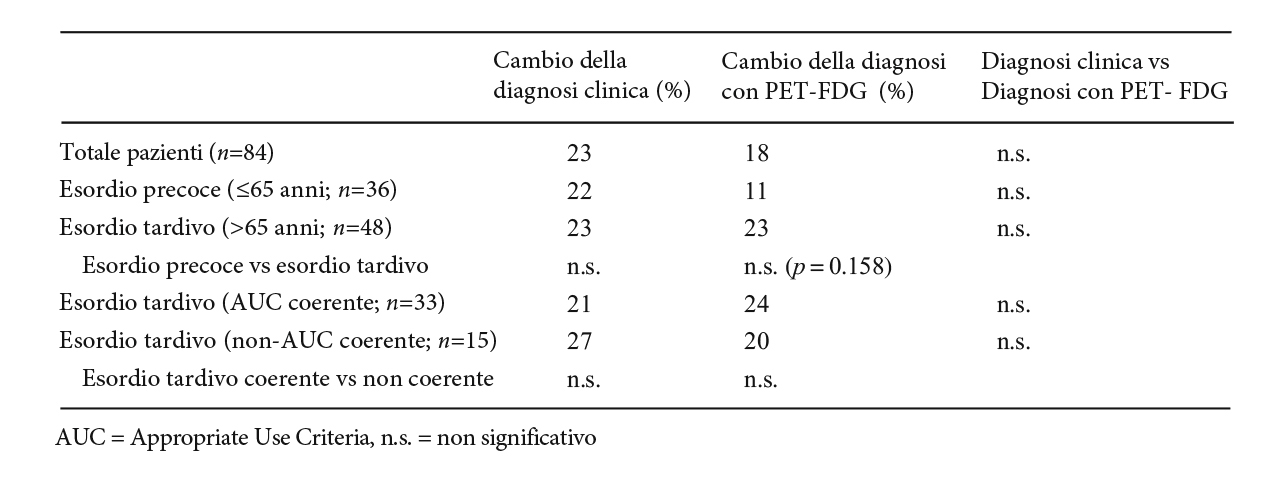
La PET amiloide ha portato ad un cambio della diagnosi nel gruppo con esclusiva valutazione clinica nel 23% dei pazienti e nel gruppo con PET [18F]-FDG nel 18%, (Tabella 2). I risultati diagnostici della PET amiloide sono stati discordanti rispetto a quelli della PET [18F]-FDG in 24 pazienti su 84 (29%) e la diagnosi con FDG PET è stata cambiata in 14 dei 24 pazienti (58%).
Tabella 2. Cambio della diagnosi dopo disclosure dei risultati della PET amiloide nel totale e nei diversi sottogruppi dei pazienti.
(riprodotta da tabella 2 di Hellwig S et al. Amyloid imaging for differential diagnosis of dementia: incremental value compared to clinical diagnosis and [18F]-FDG. Eur J Nucl Med Mol Imaging. 2019 Feb;46(2):312-323).
Accuratezza delle diagnosi rispetto alla diagnosi di consensus finale
Dopo l’analisi dei risultati della PET amiloide, l’accuratezza della diagnosi nel gruppo con esclusiva valutazione clinica è migliorata significativamente, passando dal 71% all’89% (p <0.01, McNemar test) e l’accuratezza della diagnosi nel gruppo con PET-FDG è anch’essa significativamente aumentata, dal 76% al 94% (p <0.001, McNemar test).
La correttezza dei cambi di diagnosi a seguito dei risultati della PET amiloide è stata avvalorata dalla marcata convergenza dei due percorsi diagnostici indipendenti (clinico e per imaging molecolare) e dallo spiccato incremento dell’accuratezza diagnostica, rispetto alla diagnosi consensuale finale (dal 71% all’89% e dal 76% al 94%, rispettivamente) formulata al termine del follow-up di due anni.
Take-home messages
I risultati dello studio dimostrano che i risultati della PET amiloide in aggiunta alla diagnosi clinica o per imaging molecolare con PET [18F]-FDG, porta ad un significativo incremento dell’accuratezza diagnostica.
I dati qui riportati in una popolazione di 84 pazienti vanno ad integrare in misura significativa i risultati di precedenti studi con un esteso follow-up che hanno confermato l’impatto sull’accuratezza diagnostica della PET amiloide: la diagnosi, infatti, è rimasta invariata dopo 2 anni nel 96% dei casi (22/23 pazienti) esaminati con PET [18F]-FDG e PET amiloide.
Lo studio di Hellwig solleva inoltre la questione di quale dei due approcci PET sia da impiegare nella pratica clinica (dando per scontato che l’assessment clinico rimanga indispensabile).
La PET amiloide riduce effettivamente la percentuale di pazienti con diagnosi discordanti fornite dalla valutazione clinica e dalla PET-FDG (dal 38% al 14%): anche questi risultati sono in linea con le evidenze acquisite in precedenza e con l’osservazione che la PET amiloide contribuisce in misura maggiore alla diagnosi finale, rispetto alla PET-FDG.
La diagnosi clinica iniziale combinata con la PET amiloide rappresenta una combinazione diagnostica che assicura un alto grado di accuratezza (89%). D’altro canto la combinazione PET amiloide + PET-FDG ha un’accuratezza del 94% con una notevole riduzione dei falsi-negativi (dal 13% al 4% a parità di specificità).
In conclusione, i risultati qui riportati, basati su un’analisi altamente standardizzata di dati "real life" di un’ampia popolazione di pazienti con un follow-up a due anni, dimostrano che la PET amiloide offre un significativo valore aggiunto, rispetto alla valutazione clinica e per imaging molecolare con PET-FDG per la diagnosi di AD.
©2019 Life Radiopharma Berlin GmbH - 4778
Neuraceq 300 MBq/mL soluzione iniettabile
Prezzo di vendita: 1200 euro
Classe C/Osp
Materiale Depositato presso AIFA in data 03/07/2019
Life Molecular Imaging Ltd. IT02/2019