• In gravidanza L’alimentazione materna rappresenta il fattore ambientale con la maggiore influenza sullo sviluppo embrionale e fetale, in particolare attraverso modificazioni a livello dei geni (epigenetica) coinvolti nello sviluppo fetale e placentare, che si traducono nella salute del feto e dell’adulto.
L’influenza della nutrizione materna comincia già in epoca preconcepimento, determinando l’espressione nell’ovocita in sviluppo di un DNA diverso e, di conseguenza, influenzando i geni fetali. Oltre a quello della dieta e dello stato nutrizionale, ci sono numerosi fattori che determinano lo stato di salute materna e fetale, tra cui ad es. la predisposizione genetica materna, fumo e abuso di alcolici, determinanti sociali, inquinanti ambientali e alimentari: tra questi, è particolarmente rilevante il ruolo svolto dall’obesità materna, sia attraverso la creazione di un ambiente infiammatorio, che si associa a conseguenze sfavorevoli a breve e a lungo termine per madre e figlio, sia attraverso uno squilibrio di nutrienti e lo sviluppo di ipertensione.
In particolare, l’incremento ponderale materno determina una disfunzione placentare e uno stato infiammatorio fetale, che attraverso il fetal programming predispone alla sindrome metabolica dell’adulto. Peraltro, è stato dimostrato un ruolo anche dell’obesità del maschio delle coppie subfertili, che presenta un impatto negativo su concentrazione spermatica e conta totale di spermatozoi mobili, nonché sull’espressione del DNA dei gameti maschili.
Importanza uguale a quella dell’obesità ha la malnutrizione materna, che determina denutrizione fetale con effetti in particolare a livello epatico (iperlipidemia), pancreatico (diabete tipo 2) e vascolare (ipertensione), componenti della sindrome metabolica.
• Sulla fertilità Per quanto riguarda l’influenza della nutrizione sulla fertilità, l’aderenza delle donne candidate a IVF/CSI alle raccomandazioni nutrizionali aumenta la probabilità di gravidanza (Twig JW et al. Human Reproduction 2012; 27 (8): 2526-2531).
• Sugli aborti L’influenza della nutrizione sul rischio di aborto è stata dimostrata dallo studio LIFE (Buck Louis G. Fertil Steril 2016;106:180-8), in cui è stato osservato che, sebbene lo stile di vita preconcepimento e, quindi, anche l’alimentazione, si associ al rischio di aborto, l’aderenza ad una dieta multivitaminica riduce marcatamente tale rischio.
L’80% delle coppie che pianificano una gravidanza, peraltro, presenta una malnutrizione di tipo qualitativo, per scarsa qualità dei nutrienti con ridotta quota dei micronutrienti.
Le evidenze disponibili indicano che l’aderenza alla dieta mediterranea esercita un effetto protettivo sul rischio di malformazioni fetali quali spina bifida e malformazioni cardiache, mentre una dieta inadeguata è associata al rischio di malformazioni labiali e/o palatine e ad alterazioni della crescita fetale. Nonostante tali evidenze, le modificazioni dei modelli di alimentazione hanno portato alla riduzione del contenuto in micronutrienti e a un declino dello stato nutrizionale della donna in età riproduttiva.
La malnutrizione legata ad una scarsa qualità della dieta assume una particolare rilevanza in una condizione in cui esiste una maggiore necessità di nutrienti, quale la gravidanza.

In particolare, in gravidanza si osserva un incremento delle necessità di alcuni micronutrienti, quali vitamina B6, folati, ferro, zinco, molto superiore a quello delle richieste energetiche.
Tuttavia, la dieta della popolazione generale nei Paesi industrializzati è al di sotto degli obiettivi per l’apporto di alimenti, come ad es. frutta, verdura, fibre, vitamina D, calcio e al di sopra dei limiti per alimenti, come cereali raffinati, grassi saturi e sodio.
Per quanto riguarda i folati, dai risultati di una metanalisi di 62 studi che hanno incluso oltre 100000 soggetti (Blumfields ML et al. Nutrition Reviews 2013; 71(2):118-32) è emerso che l’assunzione media di folati nei Paesi industrializzati in tutti i trimestri di gravidanza è dal 13% al 63% più bassa di quella raccomandata (Figura 1).
È ben noto il ruolo fondamentale dei folati nella sintesi di DNA, proteine e lipidi. Il 5-metiltetraidrofolato (5-MTHF), la forma attiva di folato che l’organismo utilizza , dona un gruppo metilico all’omocisteina, che è convertita in metionina e successivamente in S-adenosilmetionina (SAM), il principale donatore di metili nella cellula.
In gravidanza, le richieste di folati aumentano di 5-10 volte per la crescita fetale e lo sviluppo della placenta. Un deficit di folati interrompe la sintesi del DNA e la metilazione e causa iperomocisteinemia.
Poiché l’iperomocisteinemia si associa a complicanze e outcome sfavorevoli, quali preeclampsia e parto pretermine, in gravidanza è necessario mantenere bassa la concentrazione di omocisteina.
Uno studio prospettico (Wen SW et al. Am J Obstet Gynecol. 2008;198(1):45.e1-7) ha dimostrato che la supplementazione di acido folico al dosaggio di 1.0 mg nel secondo trimestre si associa ad una riduzione del rischio di preeclampsia.
Per quanto riguarda l’influenza dei folati sugli outcome riproduttivi, elevate concentrazioni di folato nel liquido follicolare risultano associate ad un’aumentata probabilità di gravidanza nella IVT (Boxmeer Hum Rep 2009).
Inoltre, lo status dei folati è associato alla qualità del gamete e dell’embrione e attenua la risposta ovarica all’iperstimolazione (Twigt J Clin Endocrinol Metab 2011).
Uno studio recentemente pubblicato (Parisi F et al. Fertility and Sterility 2017; 107(3)) ha dimostrato, per quanto riguarda lo sviluppo embrionario, che un livello elevato di omocisteina appare correlato con uno sviluppo più lento dell’embrione, mentre la vitamina B12, da cui dipende il ruolo del 5-MTHF nel rilascio di metionina e SAM, mostra un’associazione positiva.
Il ruolo più noto dei folati è, comunque, nella prevenzione dei Difetti del Tubo Neurale (NTD). È ben nota, infatti, l’esistenza di una correlazione inversa tra livello di folati nei globuli rossi e rischio di NTD. La maggior parte degli autori ritiene che una concentrazione di folati negli eritrociti, pari a 906 nmol/L, rappresenti il livello minimo ottimale al momento del concepimento e nei 42 giorni precedenti la gestazione per minimizzare il rischio di NTD.
Peraltro, uno studio italiano (Nilsen et al. Italian J Pediatrics 2016), su 515 donne, ha dimostrato che la maggior parte assume folati solo quando viene a conoscenza dello stato gravidico e solo il 23% circa prima del concepimento.
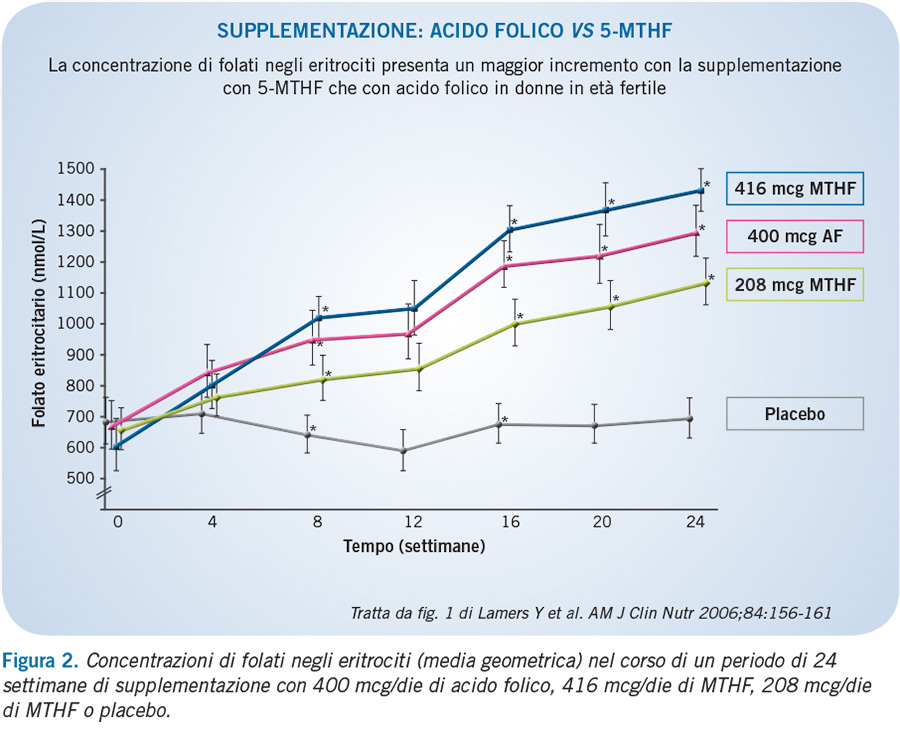
Con la supplementazione con 0.4 mg/die di acido folico è possibile ottenere un livello ottimale di folatemia >32 nmol/L (corrispondente a >906 nmol/L negli eritrociti) dopo 2-3 mesi di regolare assunzione.
La forma attiva, 5-MTHF, consente di raggiungere più rapidamente adeguate concentrazioni di folati intraeritrocitari, mantenendole nel tempo (Figura 2).
Il 5-MTHF è la principale forma di folato presente nel sangue del funicolo (media 89.4% del folato totale), in cui raggiunge una concentrazione pari a circa il doppio di quella raggiunta nel siero (media 35.8 vs 15.6 nmol/L) (Obeid et al., J Perinat Med, 2013).
La supplementazione con 5-MTHF durante la gravidanza potrebbe, pertanto, rappresentare una fonte immediata di folati trasportabili al feto.
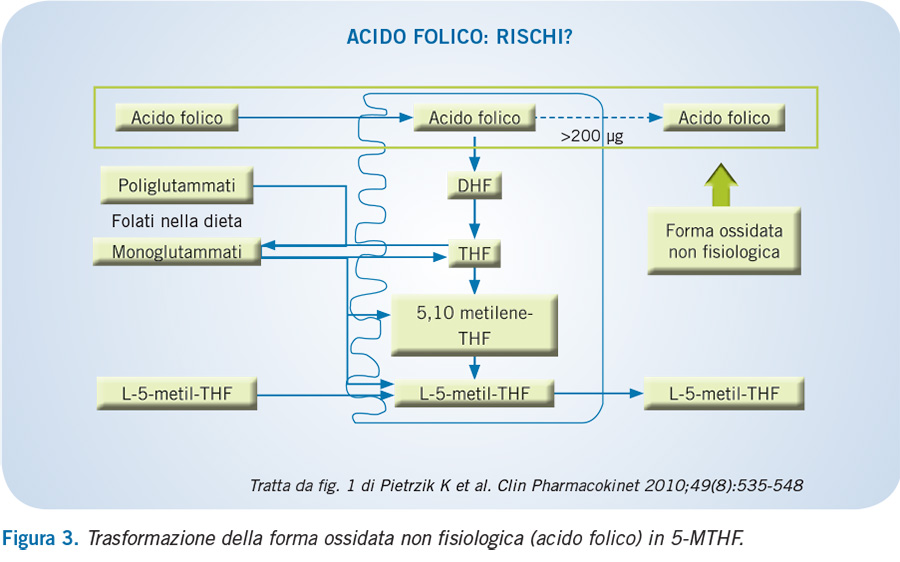
Per quanto riguarda i rischi della supplementazione di acido folico, è stato suggerito che il mascheramento del deficit di vitamina B12 in pazienti con anemia perniciosa, prevenendo lo sviluppo di anemia, consenta il progredire dei sintomi neurologici. L’alterazione dei parametri ematologici è molto frequente a dosi giornaliere di 5 mg, mentre per dosi più basse (1-5 mg/die) non si hanno dati sufficienti per stabilire una relazione di causa-effetto.
Proprio per i dubbi relativi ai potenziali effetti avversi a dosi comprese tra 1-5 mg/die e poiché elevate assunzioni di acido folico determinano la presenza di forme ossidate nel sangue, esponendo i tessuti ad una forma non fisiologica, il limite superiore della supplementazione di acido folico è stato fissato a 1 mg/die.
Perfino a dosaggi giornalieri di 15000-100000 μg l’Institute of Medicine (IOM) ha trovato limitate evidenze di tossicità diretta dell’acido folico.
La trasformazione della forma ossidata (acido folico) nella forma attiva (5-metil folato) è illustrata nella Figura 3.