
NSCLC avanzato: la risposta obiettiva al trattamento di prima linea e le decisioni terapeutiche al momento della progressione
1. Pazienti responders e non-responders al trattamento di prima linea
Nei pazienti affetti da non-small-cell lung cancer (NSCLC) avanzato, la chemioterapia contenente platino consente di ottenere una risposta obiettiva nel 20-30% dei casi (1,2). Sinteticamente, possiamo indicare con il termine “responders” i pazienti che ottengono una risposta completa (molto rara) o una risposta parziale (defi nita, in accordo ai criteri RECIST (3), come una riduzione pari ad almeno il 30% nella somma dei diametri delle lesioni identifi cate come target alla valutazione basale, ovviamente in assenza di franca progressione delle lesioni non-target e in assenza di comparsa di nuove lesioni). Al contrario, possiamo indicare con il termine “non-responders” i pazienti che non ottengono una risposta, ma solo una stabilità di malattia rispetto alla valutazione basale, oppure una precoce progressione. I pazienti con rapida progressione, ovvero i pazienti che manifestino progressione di malattia durante il trattamento di prima linea, o alla rivalutazione che segue immediatamente la fi ne del trattamento, rappresentano un gruppo a prognosi nettamente sfavorevole. Nonostante ciò, anche per una signifi cativa proporzione di questi pazienti, le discrete condizioni al momento della progressione giustifi cano comunque la possibilità di valutare un ulteriore trattamento antitumorale.
2. Impatto prognostico della risposta alla chemioterapia di prima linea
Studi condotti in pazienti che ricevevano chemioterapia di seconda linea hanno dimostrato che la risposta obiettiva precedentemente ottenuta con il trattamento chemioterapico di prima linea è un importante fattore prognostico per i pazienti che, al fallimento del suddetto trattamento, siano candidati ad una terapia di seconda linea (Figura 1).
FIGURA 1. Si potrebbe pensare che l’attività del trattamento di prima linea condizioni esclusivamente il tempo che intercorre tra l’inizio del suddetto trattamento e la progressione di malattia e che la postprogression survival sia sostanzialmente simile, indipendentemente dall’aver prima ottenuto o meno una risposta obiettiva (scenario A). Invece, anche partendo dal momento della prima progressione di malattia, ovvero dal momento in cui i pazienti vengono valutati per un eventuale trattamento di seconda linea, l’aver ottenuto una risposta obiettiva al precedente trattamento identifi ca un gruppo a prognosi migliore rispetto agli altri (scenario B). |
FIGURA 2. Curve di Kaplan-Meier di sopravvivenza globale per i pazienti con NSCLC avanzato che ricevono trattamento di seconda linea, divisi in responders e non responders al precedente trattamento di prima linea (4). I dati si riferiscono a pazienti inseriti in studi randomizzati di confronto tra vari trattamenti chemioterapici di seconda linea.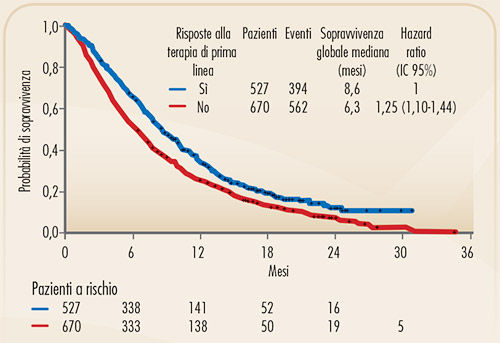 |
FIGURA 3. Calcolo dello score prognostico per i pazienti con NSCLC avanzato che ricevono trattamento di seconda linea (4).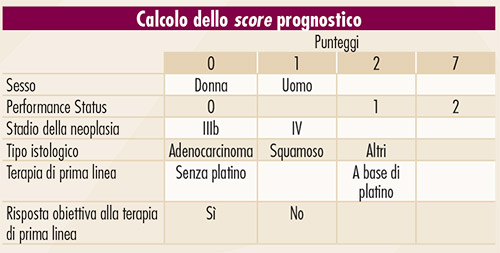 |
FIGURA 4. Curve di Kaplan-Meier di sopravvivenza globale per i pazienti con NSCLC avanzato che ricevono trattamento di seconda linea, divisi in categorie sulla base dello score prognostico (4). I dati si riferiscono a pazienti inseriti in studi randomizzati di confronto tra vari trattamenti chemioterapici di seconda linea.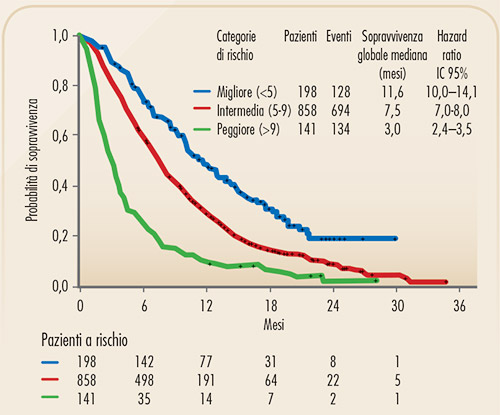 |
Ancora, un risultato simile emergeva nell’analisi dei fattori prognostici condotta nei pazienti inseriti nello studio di confronto, in seconda linea, tra pemetrexed e docetaxel (6) (Figura 5). Quest’ultimo studio valutava anche il ruolo prognostico dell’intervallo trascorso tra la fine del trattamento di prima linea e l’inizio della seconda linea, evidenziando che la prognosi peggiora al diminuire di tale intervallo (Figura 5).
FIGURA 5. Prognosi dei pazienti che ricevono trattamento chemioterapico di seconda linea, in base alla risposta ottenuta con il precedente trattamento di prima linea (4-6) e all’intervallo tra prima e seconda linea di trattamento (6).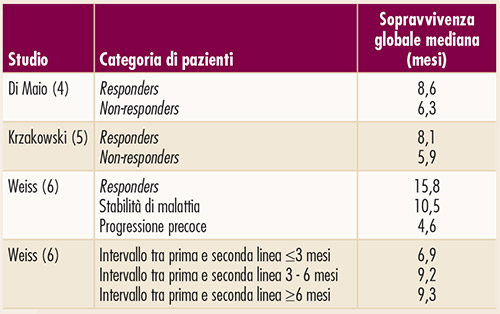 |
3. Risposta al trattamento di prima linea e scelta della seconda linea
Le terapia di seconda linea ad oggi disponibili per i pazienti con NSCLC avanzato sono la mono-chemioterapia (pemetrexed per i soli istotipi diversi dallo squamoso e docetaxel per tutti gli istotipi) e gli inibitori di Epidermal Growth Factor Receptor (EGFR): gefitinib per il NSCLC con mutazione attivante dell’EGFR ed erlotinib che ha indicazione per il NSCLC indipendentemente dallo stato mutazionale dell’EGFR e dall’istotipo. Per quanto riguarda erlotinib, lo studio BR.21 ha dimostrato l’efficacia di tale farmaco rispetto al placebo come trattamento di seconda o terza linea (7,8). L’impiego di erlotinib risultava infatti associato a un significativo prolungamento della sopravvivenza globale (mediana 6,7 mesi vs. 4,7 mesi, Hazard Ratio 0,70, p<0,001), nonché a un significativo beneficio in termini di controllo dei sintomi associati al tumore del polmone. In particolare, erlotinib determinava un significativo prolungamento del tempo al deterioramento dei tre sintomi più comuni nei pazienti con tumore del polmone (tosse, dispnea, dolore) (Figura 6), con un significativo beneficio anche in termini di funzionalità fisica e di qualità di vita globale (Figura 7) (8).
FIGURA 6. Vantaggio in termini di controllo dei sintomi associati al tumore del polmone ottenuto con l’impiego di erlotinib nello studio BR.21 (8).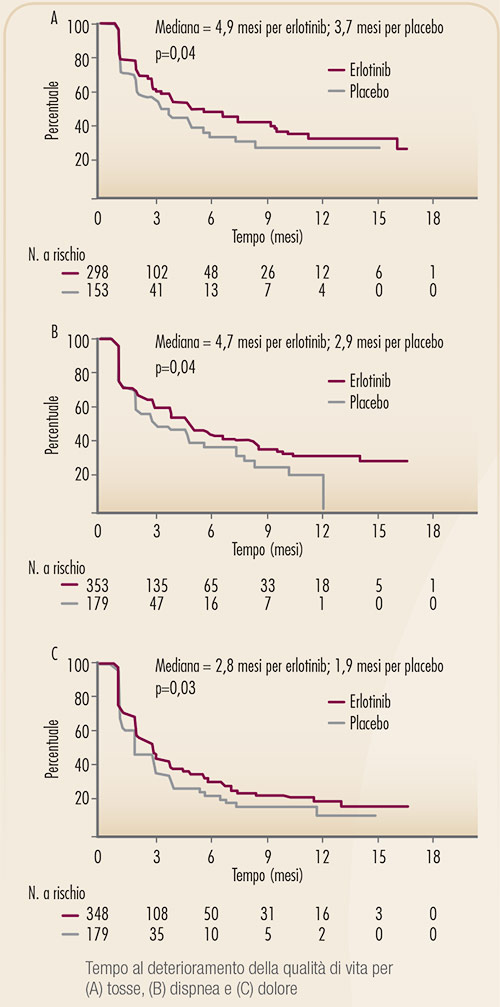 |
FIGURA 7. Proporzione di pazienti con miglioramento di qualità di vita nello studio BR.21 (erlotinib vs. placebo) (8).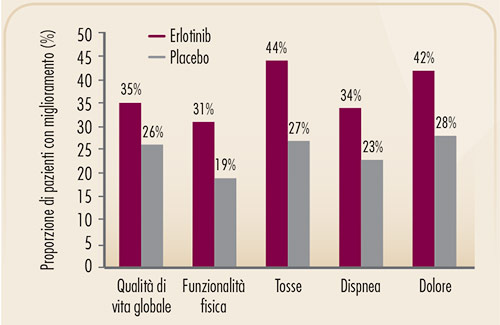 |
Lo studio TITAN (Figura 8) ha confrontato erlotinib con chemioterapia (pemetrexed o docetaxel a scelta degli sperimentatori), in pazienti che erano andati in progressione in corso di una prima linea chemioterapica (9). I risultati di questo studio, condotto in una categoria di pazienti caratterizzati da una prognosi sfavorevole, suggeriscono la possibilità di impiegare erlotinib, invece di un farmaco chemioterapico, come trattamento di seconda linea. Lo studio non ha evidenziato, infatti, alcuna differenza significativa in termini di efficacia tra erlotinib e chemioterapia (Figura 9).
FIGURA 8. Disegno dello studio randomizzato di fase III TITAN (9).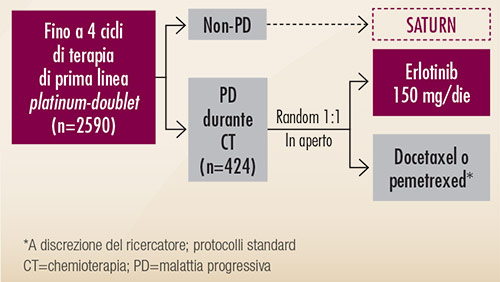 |
FIGURA 9. Curve di sopravvivenza globale dello studio TITAN (9).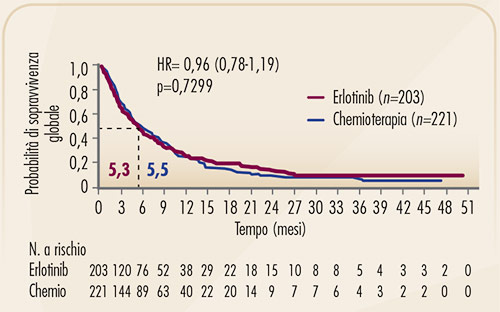 |
La chemioterapia risultava associata, rispetto ad erlotinib, ad un rischio più alto di eventi avversi seri correlati al trattamento (6,6% vs. 1,0%). Va sottolineato che la maggior parte delle tossicità più comuni con erlotinib (diarrea e tossicità cutanea) erano di intensità lieve o moderata. Lo studio randomizzato di fase III dell’Hellenic Oncology Research Group, presentato al meeting 2010 dell’American Society of Clinical Oncology (10), confrontava erlotinib e pemetrexed come trattamento di seconda linea o successiva (Figura 10). A differenza dello studio TITAN, lo studio greco prevedeva l’inserimento di pazienti indipendentemente dal tipo di risposta ottenuta con il precedente trattamento di prima linea, vale a dire sia pazienti che avessero ottenuto una risposta obiettiva con la chemioterapia, sia pazienti che non l’avessero ottenuta. La risposta obiettiva ottenuta con la terapia di prima linea rappresentava, peraltro, un criterio di stratificazione e quindi i due bracci erano bilanciati per questo importante fattore prognostico. Obiettivo primario dello studio era il time to progression: lo studio era disegnato per garantire una potenza dell’80% nell’evidenziare un’eventuale superiorità di pemetrexed rispetto ad erlotinib di 0,8 mesi in termini di time to progression mediano (3,0 vs. 2,2 mesi). Lo studio non ha dimostrato differenze significative in termini di attività ed efficacia tra i due trattamenti (Figura 11). In termini di tollerabilità, entrambi i trattamenti si confermavano poco tossici, con pemetrexed che comportava una tossicità ematologica significativamente più elevata, e con una maggiore percentuale di tossicità cutanea con erlotinib.
FIGURA 10. Disegno dello studio randomizzato di fase III del gruppo HORG (10). I pazienti erano stratificati, tra l’altro, sulla base della risposta al precedente trattamento chemioterapico, per garantire comparabilità tra i bracci anche per questo fattore prognostico.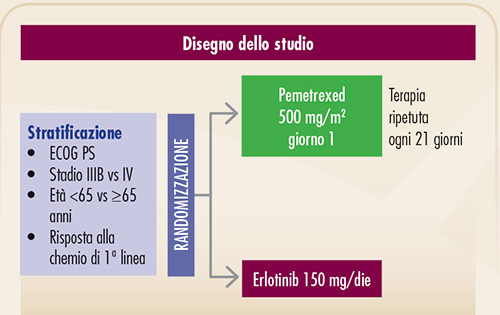 |
FIGURA 11. Principali risultati dello studio HORG (10). Risposte obiettive, time to progression e sopravvivenza globale nella popolazione complessiva e nel sottogruppo di pazienti con tumore non squamoso.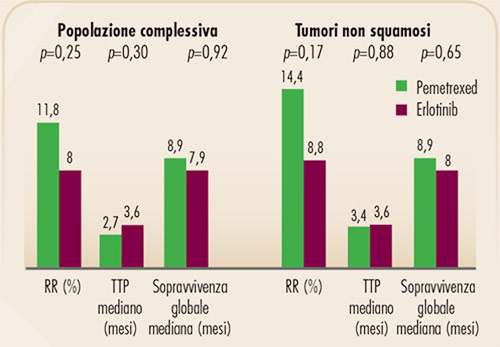 |
4. Messaggio conclusivo
La scelta dell’eventuale trattamento di seconda linea deve prendere in considerazione la risposta alla prima linea chemioterapica, nonché il rapporto tra efficacia e tossicità dei trattamenti, nell’ottica di non pregiudicare la qualità di vita dei pazienti.
• Per il gruppo di pazienti che potremmo etichettare come “chemio-sensibile”, ovvero quei pazienti che avevano ottenuto risposta con la precedente chemioterapia di prima linea, non ci sono dati di confronto che supportino una migliore efficacia della chemioterapia di seconda linea rispetto ad un inibitore di EGFR.
• Il gruppo di pazienti che potremmo definire “chemio- resistenti”, ovvero quelli che non hanno ottenuto una risposta obiettiva con il trattamento di prima linea, è caratterizzato da un’aspettativa di vita peggiore rispetto al gruppo precedente. I dati di confronto diretto tra erlotinib e chemioterapia dimostrano che in tali pazienti erlotinib rappresenta una valida opzione terapeutica.
|