
TRATTAMENTO DELLE AFFEZIONI RESPIRATORIE CON IPERSECREZIONE DENSA E VISCHIOSA: Focus su N-acetilcisteina
IL MUCO E LE SUE FUNZIONI
La secrezione mucosa rappresenta la prima linea di difesa contro le sostanze irritanti che l’inalazione di circa 500 litri di aria all’ora veicola nelle vie respiratorie. L’inalazione di fumi, polveri, microbi e gas può danneggiare l’epitelio delle vie respiratorie. La secrezione mucosa è un processo efficiente che si realizza in tempi molto rapidi proprio per contrastare questa “invasione” (1). Il muco delle vie respiratorie è una soluzione acquosa di lipidi, glicoconiugati e proteine. Contiene elettroliti, enzimi ed anti-enzimi, ossidanti e antiossidanti, prodotti di batteri esogeni, secrezioni antibatteriche endogene, mediatori e proteine di derivazione cellulare e plasmatica (1). Macroscopicamente il muco appare come un gel viscoelastico che forma un film sottile sulla superficie delle vie aeree (Figura 1).
FIGURA 1. Immagine della superficie interna di un bronco (microscopio elettronico a scansione). Si nota il muco (M) al di sopra delle cellule ciliate (C) [Figura 1 di (1)] |
Il muco delle vie aeree, importante meccanismo di difesa omeostatico, svolge una serie di funzioni (Tabella 1) (1).
TABELLA 1. Le funzioni del muco [Tabella 1 di (1)] |
SECREZIONE E IPERSECREZIONE MUCOSA
In condizioni fisiologiche, all’interno delle vie respiratorie sane il muco forma un doppio strato al di sopra dell’epitelio, con un surfattante che separa lo strato “gel” dallo strato “sol” (1). Le mucine secrete dalle cellule mucipari caliciformi e dalle ghiandole sottomucose conferiscono alla secrezione la tipica viscoelasticità, che facilita la clearance mucociliare delle particelle e degli irritanti inalati. L’idratazione del muco è regolata dal flusso di elettroliti (e quindi di acqua) attraverso l’epitelio. Anche le ghiandole sottomucose sono in grado di secernere acqua. Le proteine plasmatiche diffondono dal microcircolo tracheobronchiale alla mucosa, contribuendo alla formazione del muco. Un’efficace clearance del muco è essenziale per l’efficienza del sistema respiratorio (2). I processi infiammatori (come quelli che si determinano nella bronchite cronica e nell’asma) provocano una serie di alterazioni delle secrezioni mucose. La trasformazione del muco da fisiologico in patologico, in risposta allo stimolo infiammatorio, si verifica attraverso vari meccanismi che portano ad una modifica dei suoi costituenti e del contenuto di acqua: in tali condizioni si ha un’anomala secrezione di elettroliti e di acqua, con aumento della produzione di mucine (2), iperplasia delle cellule caliciformi e ipertrofia delle ghiandole sottomucose (1), infiltrazione di cellule infiammatorie nel muco (2) e aumento della permeabilità vascolare. L’accumulo di muco è il risultato di una combinazione di ipersecrezione e di ridotta clearance; il persistente accumulo di secrezioni può favorire la crescita batterica e l’infezione (2). L’ipersecrezione mucosa si realizza secondo due modalità principali, tipiche rispettivamente dell’asma e della BPCO. Le caratteristiche alterazioni della composizione del muco in queste due condizioni realizzano fenotipi ipersecretivi diversi (Figura 2).
FIGURA 2. Secrezione e ipersecrezione mucosa [Modificata da Figura 4 di (2)] |
IPERSECREZIONE MUCOSA: SEGNI, SINTOMI E QUADRI CLINICI
La presenza di ipersecrezione nelle vie respiratorie nel corso di un processo infiammatorio acuto o cronico si manifesta con una serie di correlati clinici. I sintomi principali della ridotta clearance mucociliare sono la tosse e la dispnea. La prima è causata dalla stimolazione di fibre afferenti vagali a livello delle vie aeree basse, della laringe e della faringe (2). La dispnea si genera invece quando il muco accumulato e denso ostruisce il flusso aereo occupando il lume delle vie (vedi Figura 2) (2). Oltre alla tosse, altri segni obiettivi di ridotta clearance mucociliare comprendono il reperto auscultatorio di ronchi e sibili. Alla radiografia diretta del torace, il muco accumulato e gli essudati infiammatori possono apparire sotto forma di atelettasie localizzate o opacità lineari o ramificate (2), mentre alla TAC si evidenzia l’obliterazione del lume nelle vie prossimali o opacità tipo tree-in-bud (cosiddetto albero in fiore) nelle vie periferiche (2). È importante riconoscere il ruolo che il muco ha nel determinismo dei quadri clinici di malattia, in quanto l’eliminazione dell’ipersecrezione densa e vischiosa rappresenta un obiettivo terapeutico di primaria importanza e permette tra l’altro un’efficace somministrazione di altre terapie (es. aerosol) (2). Oltre ai principali fenotipi ipersecretivi dell’asma e della BPCO (con i quadri sovrapposti di bronchite cronica, bronchiolite ed enfisema) (1), descritti in sintesi nella figura 2, virtualmente ogni malattia infiammatoria delle vie respiratorie comporta alterazioni della normale secrezione mucosa (2). Le infezioni virali e batteriche acute e molte patologie respiratorie croniche presentano tutte l’elemento comune di un’alterazione della secrezione mucosa in senso ipersecretivo (2).
TRATTAMENTO DELL’IPERSECREZIONE DELLE VIE RESPIRATORIE
Sono essenzialmente due gli obiettivi del trattamento dell’ipersecrezione mucosa respiratoria: il sollievo sintomatico a breve termine e il beneficio clinico a lungo termine (3) (Tabella 2). Sono disponibili diverse molecole per il trattamento delle affezioni respiratorie con ipersecrezione.
TABELLA 2. Obiettivi terapeutici del trattamento farmacologico dell’ipersecrezione mucosa nell’asma e nella BPCO [Modificata da Tabella 1 di (3)] |
Per la maggior parte si tratta di sostanze con meccanismo d’azione non completamente noto o solo parzialmente caratterizzato. Una suddivisione generale di queste sostanze è riportata nella seguente tabella 3 (3).
TABELLA 3. Agenti mucoattivi e meccanismi di azione ipotizzati [Modificata da Tabella 4 di (3)] |
N-ACETILCISTEINA (NAC): EFFETTI E VANTAGGI NELL’IMPIEGO CLINICO
Effetti farmacodinamici di NAC
N-acetilcisteina (NAC) è il mucolitico più diffuso al mondo ed è impiegato da molti anni nel trattamento di pazienti con diverse affezioni respiratorie (3). Le sue proprietà mucolitiche dipendono dalla capacità di NAC di rompere i ponti disolfuro e di ridurre così la viscoelasticità del muco (4). NAC è inoltre in grado di promuovere la sintesi di glutatione e può agire come diretto “scavenger” di radicali liberi (4) svolgendo così un ruolo importante nella difesa antiossidante (4). NAC ha anche attività antinfiammatoria, essendo in grado di modulare lo stato redox cellulare contribuendo a ridurre l’attività del fattore di trascrizione NF-κB che regola la trascrizione di una serie di geni proinfiammatori (4). Infine sono note da tempo le proprietà antibatteriche di NAC, relative alla capacità di questa molecola di ridurre la formazione dei biofilm batterici ovvero degli aggregati di microrganismi che notoriamente giocano un ruolo molto importante nella patogenesi di molte affezioni respiratorie croniche e/o ricorrenti (5).
NAC nel trattamento della BPCO
Nei pazienti con BPCO, NAC migliora la funzione polmonare quando somministrato per lunghi periodi tempo (4). Pela et al. (6) hanno riportato significativi miglioramenti del VEMS (Volume Espiratorio massimo nel 1° secondo) e del MEF 50 (Massimo Flusso Espiratorio al 50% della VC forzata) dopo 6 mesi di trattamento con NAC orale in pazienti con BPCO stabile (6). Una review condotta da Stey et al. nel 2000 ha evidenziato che NAC aumenta significativamente la percentuale di soggetti affetti da BPCO senza riacutizzazioni (48.5% vs 31.2% con placebo, con un beneficio relativo di 1.56 a favore di NAC) (dati relativi a 9 studi) (Figura 3) (7). NAC inoltre ha migliorato la sintomatologia nel 61.4% dei pazienti (vs 34.6 con placebo; beneficio relativo 1.78) (dati relativi a 5 trial) (7). Nel 2003, Gerrits et al. (8) hanno osservato una correlazione diretta tra il dosaggio di NAC e il numero di ospedalizzazioni per riacutizzazioni di BPCO e hanno riportato che NAC riduce il rischio di riospedalizzazione del 30% (4,8) (Figura 4). Un altro dato interessante emerso nello studio di Gerrits è che la riduzione del rischio di ricovero in questi pazienti richiede una dose minima di NAC che corrisponde a 400 mg/die, necessaria per il raggiungimento dell’effetto protettivo del mucolitico (8). Tale dosaggio (400 mg/die in dosaggio singolo) è quello approvato (9) anche in Italia per i trattamenti prolungati (prevenzione delle riacutizzazioni in pazienti con bronchite cronica) (9). Come già accennato, NAC interferisce con diversi fattori coinvolti nella modulazione della risposta infiammatoria.
FIGURA 3. Assenza di riacutizzazioni in trattamento con NAC (o placebo) in pazienti con BPCO o bronchite cronica (ogni simbolo rappresenta un trial della review). Le frecce indicano la percentuale media di pazienti liberi da riacutizzazione (vedi testo) [Figura 1 di (7)]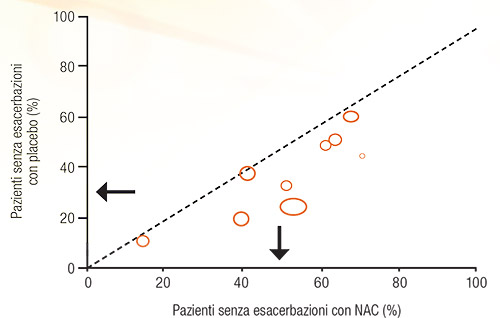 |
FIGURA 4. Rischio di riospedalizzazione per BPCO in pazienti trattati con o senza NAC [Figura 1 di (8)]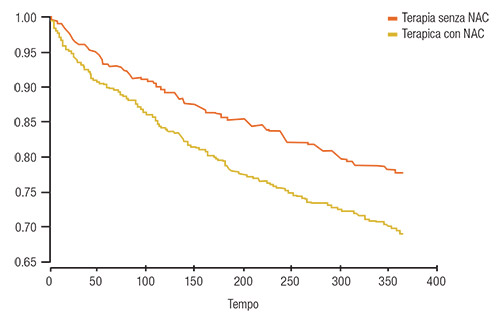 |
In particolare NAC riduce le proprietà chemioattrattanti (chemiotattiche) dell’espettorato di pazienti con BPCO (4) e potenzia l’attività fagocitica dei neutrofili, mentre riduce la formazione di anione superossido (4), incrementando l’attività della superossido-dismutasi (4). Questi ed altri effetti sperimentalmente e clinicamente dimostrati confermano l’attività antiossidante ed antinfiammatoria di NAC, che unite alle note proprietà mucolitiche rendono NAC estremamente utile nei pazienti con affezioni respiratorie acute e croniche. NAC riduce la dispnea nei pazienti con BPCO, migliorando la performance clinica complessiva e tutti i sintomi correlati con lo stato bronchitico (4). Tali effetti hanno un impatto significativo sulla qualità di vita dei pazienti, come dimostra la già citata esperienza clinica di Pela et al. (6) che ha riportato un miglioramento della QoL nel 65% dei pazienti BPCO trattati con NAC (vs 29% dei pazienti placebo).
Altre indicazioni di NAC
Grazie al suo articolato profilo farmacodinamico, l’impiego di NAC risulta vantaggioso in tutte le affezioni respiratorie con componente infiammatoria e ipersecretiva, acute e croniche. Ad esempio è stato dimostrato che questo mucolitico riduce significativamente i sintomi influenzali specie nei soggetti ad alto rischio di complicazioni batteriche, come gli anziani (10) (Figura 5). Il trattamento con NAC riduce la frequenza complessiva di episodi influenzali nel gruppo di pazienti trattati.
In pazienti con fibrosi polmonare interstiziale idiopatica trattati con prednisone e azatioprina, la somministrazione di alte dosi di NAC ha preservato la funzione polmonare (riducendo l’entità del deterioramento) (11) e ha inoltre ridotto gli effetti collaterali mielotossici associati alla azatioprina della terapia standard della fibrosi (11). NAC è stata anche utilizzata nella prevenzione delle complicanze post-operatorie respiratorie e non (12). Accenneremo infine, solo per dare una completezza al rapido profilo delineato, che NAC ha riportato risultati in diversi trattamenti: dall’impiego come coadiuvante alla terapia con clomifene citrato nelle donne affette da policistosi ovarica, alla prevenzione della nefropatia da mezzo di contrasto, senza dimenticare l’impiego diffuso di NAC come antidoto dell’iperdosaggio di paracetamolo (12). Questa rapida rassegna delle evidenze disponibili permette di concludere che il ruolo potenziale di NAC nel trattamento delle affezioni respiratorie con ipersecrezione va oltre la ben nota attività mucolitica, in quanto si basa anche su altri potenziali effetti della molecola, da quello antinfiammatorio, a quello antiossidante e antibatterico, grazie ai quali NAC può agire sulle principali componenti fisiopatologiche e patogenetiche delle affezioni nelle quali trova indicazione.
FIGURA 5. Frequenza cumulativa dei sintomi influenzali negli anziani trattati con NAC o Placebo. *p<0.05; +p<0.0001 [Figura 2 di (10)]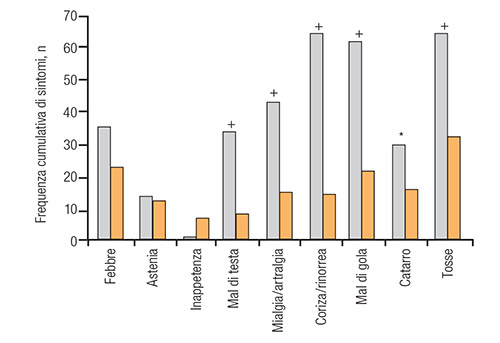 |
|