

Gli elevati livelli di ormone della crescita (Growth Hormone, GH) e l’aumentata concentrazione del fattore di crescita insulino- simile 1 (IGF-1) determinano, nei pazienti affetti da acromegalia, effetti pleiotropici patologici a carico di numerosi organi ed apparati (1), responsabili di comorbidità cardiovascolari, respiratorie e metaboliche e di aumento della mortalità (2) (Figura 1).
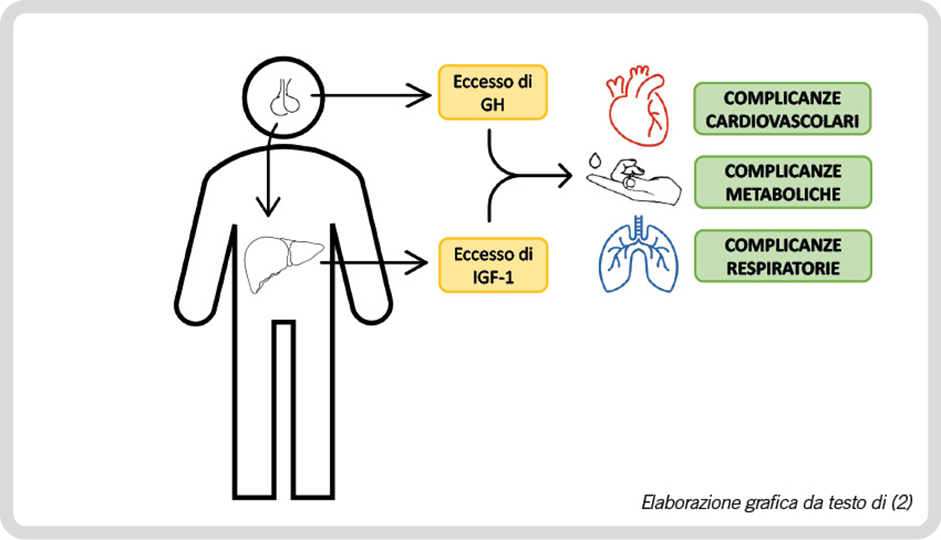
Figura 1. Principali cause di aumentata mortalità nel paziente con acromegalia.
In particolare, i pazienti acromegalici presentano un rischio 1,85 volte superiore di sviluppare complicanze respiratorie rispetto alla popolazione normale, che risultano responsabili di circa il 25% di tutte le morti (3,4). La più frequente complicanza respiratoria è la Sindrome delle Apnee Ostruttive del Sonno (OSAS), che appartiene allo spettro dei Disturbi Respiratori nel Sonno (DRS), la cui frequenza si aggira tra il 45 e l’87,5% (5), ma ulteriori complicanze polmonari, benché meno note e frequenti, possono essere alla base di ipossia da sforzo e ridotta tolleranza all’esercizio fisico, e andrebbero sempre valutate nel percorso diagnostico di un paziente acromegalico che riferisca dispnea.
È noto che le elevate concentrazioni di GH/IGF-1 possono determinare alterazioni anatomiche a carico non solo delle ossa, ma anche dei tessuti molli del distretto testa-collo, con frequenti fenomeni di macroglossia, facile collassabilità del faringe e conseguente aumento delle resistenze con ostruzione delle alte vie aeree, specialmente durante il sonno. Questo meccanismo fisiopatologico è alla base dei DRS, quali OSAS ed apnee centrali (2,3) che richiedono accurata anamnesi ipnologica e studio polisonnografico (5).
Più rare sono le alterazioni respiratorie diurne legate all’aumentato carico resistivo delle vie aeree superiori durante la veglia con fenomeni ostruttivi sia nella fase di inspirazione che in quella di espirazione, con aumento del lavoro muscolare respiratorio per garantire un adeguato flusso aereo, soprattutto durante lo sforzo.
Una revisione sistematica della letteratura, nel 2020, mostrava come il sintomo più frequente sia la dispnea, anche per sforzi moderati ed in assenza di anamnesi respiratoria patologica, seguita dallo “stridor” e dalla disfonia (6), anche se sono necessari studi caso- controllo per valutarne l’effettiva prevalenza rispetto alla popolazione generale.
L’ostruzione dinamica delle alte vie aeree è ben valutabile dalla spirometria, con caratteristiche alterazioni nella morfologia della curva flusso/volume ottenuta durante la espirazione e l’inspirazione forzate massimale, con un caratteristico plateau del picco di flusso espiratorio, una caratteristica indentatura del tracciato espiratorio con aspetto “a denti di sega” e con una limitazione anche del flusso inspiratorio, alla base dei sintomi respiratori riferiti.
La localizzazione toracica delle alterazioni ossee, cartilaginee e muscolari del paziente acromegalico possano determinare deformità scheletriche, riscontrabili fino al 60% dei pazienti, sotto forma di cifoscoliosi ed esiti di fratture vertebrali, con conseguenti alterazioni della compliance e della elastanza toraco-polmonare e possibile deficit ventilatorio di tipo restrittivo, che anche in questo caso sottende un aumento del lavoro muscolare respiratorio per garantire un adeguato ricambio dell’aria alveolare durante lo sforzo e conseguenti sintomi come la dispnea da sforzo e la riduzione della capacità di esercizio fisico.
In aggiunta, l’eccesso di GH/IGF-1 può determinare fenomeni di ipertrofia e degenerazione delle fibre muscolari, con conseguente aumentata fatica muscolare. La dinamica respiratoria nel paziente acromegalico sarà dunque caratterizzata da una ridotta forza sia in inspirazione che in espirazione, nonché da un ridotto tempo inspiratorio con conseguente aumento compensatorio della frequenza respiratoria (4).
È ampiamente riportato in letteratura l’aumento della compliance polmonare statica nel paziente acromegalico, attribuibile ad aumento del volume degli alveoli e del volume residuo, rilevabile con la pletismografia corporea o con la TC toracica ad alta risoluzione.
Un interessante studio caso-controllo ha mostrato un aumento della compliance ed una riduzione della pressione trans-polmonare in massima inspirazione, parzialmente reversibili dopo terapia medica specifica per l’acromegalia (7), mentre diversi studi scientifici confermano l’aumento globale dei volumi polmonari statici attribuibile nei pazienti acromegalici all’aumentata concentrazione di GH/IGF-1 che stimola iperplasia, ipertrofia o aumento in numero degli alveoli e rottura dei setti interalveolari (8).
Alla spirometria globale, la capacità polmonare totale (TLC), la capacità vitale lenta (SVC), forzata (FVC) ed i volumi residui (RV) risultano aumentati dal 110% al 160% dei valori predetti (3,9,10,11). In analogia con i riscontri spirometrici, anche alla TC torace è stato notato un aumento volumetrico sia in termini di massa polmonare totale (TC in massima inspirazione), che di regioni anatomiche scarsamente areate (TC in massima espirazione) (12).
La mancanza di un corrispettivo aumento della perfusione polmonare può, tuttavia, determinare un aumento dello spazio morto fisiologico, con rilevante quota di alveoli ventilati ma non perfusi e secondari fenomeni di alterazioni degli scambi gassosi, soprattutto a riposo.
Relativamente ai flussi aerei espiratori, rilevabili in corso di manovre di espirazione forzata nella spirometria, è ampiamente condiviso in letteratura l’aumento del FEV1 (Forced Expiratory Volume in the 1st second o VEMS, Volume espiratorio massimo nel 1° secondo) nella patologia acromegalica (9,10) (Figura 2), mentre l’ostruzione delle piccole vie aeree, sprovviste di impalcatura cartilaginea, e frequentemente rilevata, è oggetto di opinioni contrastanti: Camilo et al. riportano una normalità del flusso espiratorio forzato tra il 25% ed il 75% della capacità vitale (FEF25-75%), a fronte di un incremento delle resistenze (Praw) e di un’aumentata frequenza di “air trapping”, valutato mediante TC torace (9), mentre Störman et al. hanno riscontrato una riduzione clinicamente significativa del massimo flusso espiratorio al 75% della capacità vitale (MEF75%) (11).
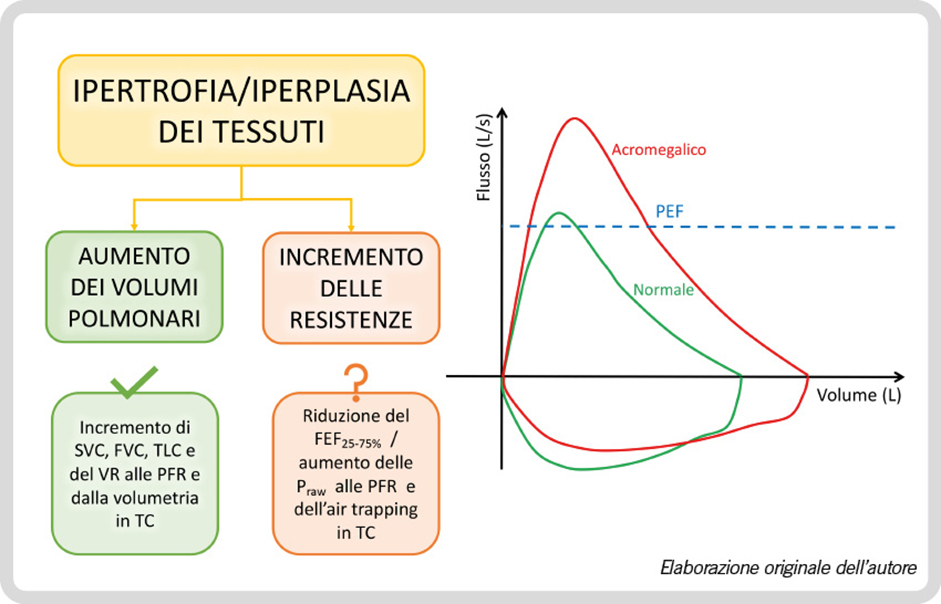
Figura 2. Alterazioni della funzionalità respiratoria nell’acromegalia. SVC, Capacità Vitale Lenta; FVC, Capacità Vitale Forzata; TLC, Capacità Polmonare Totale; VR, Volume Residuo; PFR, Prove di Funzionalità Respiratoria; TC, Tomografia Computerizzata; FEF25-75%, Flusso Espiratorio Forzato tra il 25% e il 75% della FCV; Praw, resistenza delle vie aeree.
Anche per quanto riguarda la capacità di diffusione alveolo-capillare sono riportati riscontri contrastanti in letteratura: alcuni studi riportano una ridotta diffusione alveolo-capillare del monossido di carbonio (DLCO) (13), altri un aumento (14), mentre la maggior parte una normalità della capacità di diffusione (8,9).
In generale un incremento dei volumi polmonari può determinare un aumento della DLCO, con normalità della capacità di diffusione corretta per il volume alveolare che partecipa agli scambi gassosi (fattore di Krogh), ma, come sopra riportato, in quei casi in cui non via sia un corrispondente aumento della perfusione la DLCO può risultare viceversa ridotta (14,15).
Ulteriori studi sono necessari per una migliore comprensione della diffusione alveolo-capillare nel paziente con acromegalia.
La correlazione tra neoplasie polmonari e l’eccesso di GH/IGF-1 è stata ipotizzata da uno studio sperimentale condotto da Khandwala et al. (16).
Tuttavia, studi caso-controllo non hanno mostrato differenze statisticamente significative di prevalenza tra pazienti con acromegalia e soggetti sani (17,18).
A causa delle alterazioni precedentemente citate della dinamica respiratoria e di frequenti comorbidità cardiovascolari, i pazienti con acromegalia presentano frequentemente alterate risposte ventilatorie e muscolari allo sforzo fisico: studi clinici riportano infatti una riduzione del carico di lavoro al cicloergometro sia nella soglia anaerobica che nell’esercizio massimale (4).
Nello specifico, Giustina et al. (19) in uno studio-controllo su 10 pazienti acromegalici hanno notato notevoli riduzioni della performance al test cardiopolmonare da sforzo, rispetto a soggetti sani (Figura 3).
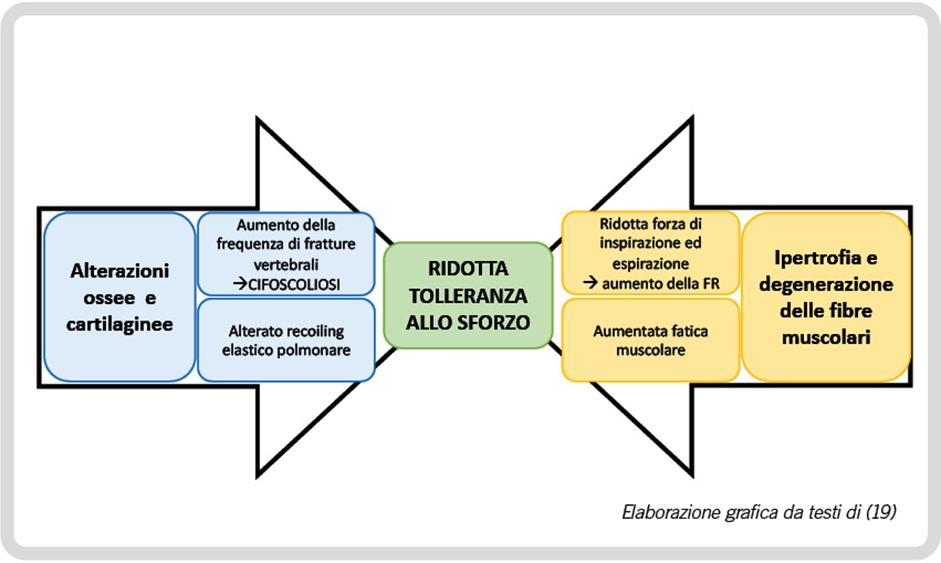
Figura 3. Ridotta tolleranza allo sforzo: cause respiratorie. FR, Frequenza Respiratoria.
Le complicanze respiratorie dell’acromegalia possono essere distinte in notturne e diurne: le prime sono di maggior rilevanza per prevalenza ed impatto sistemico, mentre le seconde possono essere alla base di ridotta tolleranza allo sforzo e dispnea e, benchè meno frequenti, possono aggravare le condizioni cliniche di un paziente con plurime comorbidità.
Mentre l’OSAS è un riconosciuto fattore di rischio cardiovascolare indipendente attraverso numerosi meccanismi fisiopatologici, tra cui l’ipossia intermittente/remittente (IHR) e lo stress ossidativo (20), l’attività fisica svolge un ruolo fondamentale nella prevenzione primaria e secondaria di patologie croniche quali malattie cardiovascolari, diabete ed obesità (21) e, pertanto, la ridotta tolleranza allo sforzo fisico secondaria a complicanze respiratorie diurne potrebbe comportare l’instaurarsi di un circolo vizioso, che si esplica con un aumento esponenziale del rischio cardiovascolare e, più in generale, con scadimento della qualità di vita e depressione frequentemente riferite dai pazienti acromegalici.
Risultano quindi, in conclusione, di fondamentale importanza sia la diagnosi precoce ed il trattamento dell’OSAS, che l’individuazione, con un percorso diagnostico strumentale, di eventuali alterazioni respiratorie diurne sia della ventilazione che della diffusione e della perfusione, con interventi terapeutici e riabilitativi mirati ad aumentare la tolleranza allo sforzo del paziente con acromegalia.