

l tumore prostatico metastatico hormone-naïve (mHSPC) rappresenta una fase avanzata della malattia prostatica che richiede un approccio terapeutico complesso e integrato. L’incidenza specifica del mHSPC può variare notevolmente a seconda di fattori demografici, ambientali e genetici, nonché delle pratiche di screening e diagnosi nelle diverse regioni del mondo. La sopravvivenza mediana dei pazienti con nuova diagnosi di mHSPC è approssimativamente di 42 mesi con la sola terapia ormonale androgeno deprivante (ADT). Tuttavia, questo parametro è variabile a causa dell’eterogeneità dei pazienti (1). Diversi fattori prognostici influenzano la sopravvivenza e tra questi il numero e la localizzazione delle metastasi sia viscerali che ossee, il grado ISUP ed il performance status.
La sintomatologia di questi pazienti può variare a seconda di diversi fattori, tra cui l’estensione e la localizzazione delle metastasi (Tabella 1).
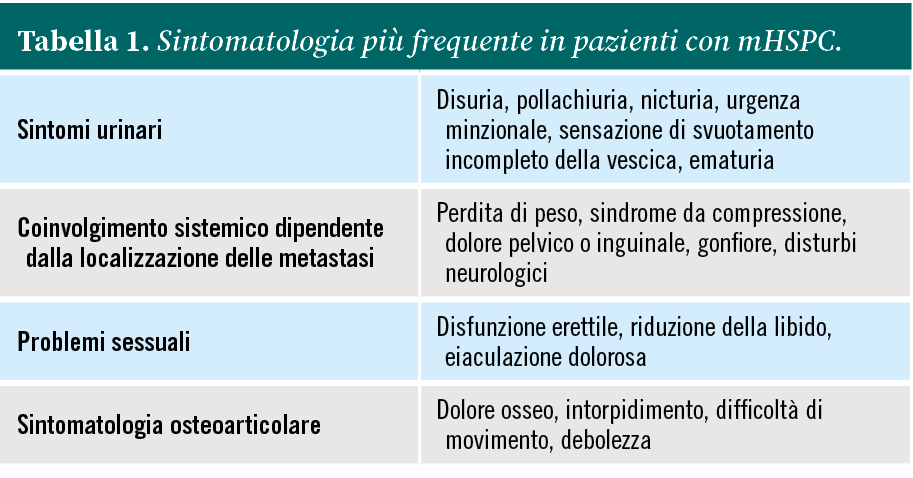
Tra i sintomi più frequenti si annoverano disuria, pollachiuria, urgenza minzionale, ematuria o sensazione di svuotamento incompleto, sintomi legati alla compressione di organi vicini, sintomi sistemici e problemi di carattere sessuale.
Gli androgeni, come il testosterone, sono noti per stimolare la crescita delle cellule tumorali della prostata. Per questo motivo ridurne i livelli è diventato un obiettivo terapeutico importate nel carcinoma della prostata. Negli anni 50 furono scoperti i benefici della castrazione chirurgica nel trattamento del carcinoma prostatico avanzato; tuttavia, questa procedura aveva importanti implicazioni fisiche e psicologiche per i pazienti. Per questo motivo, negli anni successivi furono introdotti i primi farmaci ormonali capaci di ridurre i livelli di testosterone. La continua ricerca ha permesso successivamente lo sviluppo di agenti antiandrogeni, come flutamide e bicalutamide, che agiscono inibendo i recettori degli androgeni nelle cellule tumorali, fino ad arrivare allo sviluppo degli agonisti dell’ormone di rilascio del LH (LHRH).
Ad oggi, l’ADT rappresenta la base del trattamento dell’mHSPC ed è di fondamentale importanza che tale terapia venga intrapresa il prima possibile, in modo da rallentare la progressione della malattia e migliorare i sintomi del paziente. Uno dei principali limiti di tale terapia è dato dall’evoluzione verso una fase di malattia metastatica resistente alla castrazione (mCRPC). Ad oggi, tuttavia, l’ADT da sola non rappresenta più l’unica terapia disponibile.
Sono, infatti, disponibili terapie combinate in aggiunta alla terapia ormonale standard e numerosi studi clinici hanno dimostrato i benefici di tali strategie combinate mettendo in evidenza un significativo prolungamento della sopravvivenza globale libera da progressione del paziente. Inoltre, nell’era della tailored-therapy, le modalità di trattamento del mHSPC sono in continua evoluzione e fattori clinici come la tipologia di insorgenza ed il volume di malattia sono strettamente correlati alla prognosi.
Tali caratteristiche sono di fondamentale importanza nel prevedere il beneficio delle possibili strategie terapeutiche al fine di garantire al paziente la miglior terapia personalizzata tra quelle attualmente disponibili. La gestione del mHSPC può, infatti, implicare anche una combinazione di terapie ormonali, chemioterapia, immunoterapia e radioterapia a seconda delle caratteristiche specifiche del paziente e della malattia. L’efficacia della terapia di combinazione per la gestione del mHSPC deve il suo successo ai risultati ottenuti anche nel trattamento dei tumori della prostata resistenti alla castrazione (mCRPC) (2-4).
Gli inibitori del segnale del recettore androgenico (ARSI) agiscono bloccando il recettore degli androgeni e le vie di segnalazione coinvolte nella crescita tumorale. La terapia di combinazione con la terapia ormonale standard può portare ad un significativo prolungamento della sopravvivenza libera da progressione e della sopravvivenza globale nei pazienti con mHSPC metastatico. Come analizzato da Hamid et al. (2023), numerosi trial clinici in fase III hanno valutato l’efficacia degli ARSI in associazione all’ADT (2).
L’Abiraterone Acetato è stato valutato nei trials STAMPEDE e LATITUDE. Il trial STAMPEDE ha evidenziato come la terapia in associazione di ADT più Abiraterone e Prednisone avesse un significativo vantaggio in termini di prolungamento della sopravvivenza (overall survival – OS) e un vantaggio sul tempo di insorgenza di manifestazioni scheletriche sintomatiche principalmente nel sottogruppo di pazienti con malattia metastatica sincrona. Tali risultati sono stati confermati anche dallo studio LATITUDE, sottolineando, già con un follow-up mediano di 30,4 mesi (valutazione ad interim), il beneficio ottenuto in termini di OS, tempo di progressione del dolore, tempo di inizio della chemioterapia con un rischio relativo di morte e di progressione radiologica significativamente più basso nel gruppo in terapia di combinazione (5).
Il beneficio clinico complessivo nel rallentare la progressione della malattia ha reso l’Abiraterone una proposta concreta nel trattamento del carcinoma prostatico sensibile alla castrazione. Oltre all’Abiraterone, diversi ARSI di nuova generazione (Apalutamide, Darolutamide e Enzalutamide) sono stati presentati nel corso degli anni. Gli studi ENZAMET ed ARCHES hanno messo in evidenza i benefici della terapia di combinazione con Enzalutamide rispetto alla sola ADT in termini di prolungamento dell’OS (6).
L’Apalutamide è stato invece valutato nello studio TITAN, fissando come end point primari il tempo di sopravvivenza libero da progressione radiologica rPFS ed OS e come end point secondari il tempo all’utilizzo di una chemioterapia, il tempo di insorgenza di nuovi eventi scheletrici sintomatici e di progressione del dolore con ricorso all’utilizzo cronico di farmaci oppioidi. In tale studio è evidenziato l’elevato beneficio della terapia di associazione rispetto alla sola ADT, indipendentemente dal timing o dal volume di malattia metastatica in termini di prolungamento dell’OS e di rPFS (7). I promettenti risultati ottenuti hanno fatto si che venisse interrotta la cecità dello studio autorizzando l’utilizzo dell’Apalutamide anche nel braccio del placebo.
Una importante rivoluzione nella terapia del carcinoma prostatico metastatico è avvenuta con la pubblicazione dei risultati dello studio CHAARTED che hanno mostrato l’efficacia del Docetaxel in associazione alla terapia di deprivazione androgenica (ADT) nei pazienti affetti da malattia metastatica ormono-sensibile (mHSPC).
Infatti, lo studio CHAARTED è stato il primo ad evidenziare come nei pazienti con la terapia di associazione ci fosse un significativo prolungamento della sopravvivenza globale, rispetto a quelli trattati con la sola terapia ormonale. Si è evidenziato che, non solo c’era un vantaggio negli end point primari come la OS, ma anche un miglioramento in end point secondari quali il tempo di evoluzione in CRPC e la proporzione di pazienti che presentavano un valore di PSA minore di 0,2 ng/ml a 12 mesi dall’inizio della terapia (2).
Lo studio CHAARTED ha messo anche in evidenza come l’efficacia dell’associazione di ADT con Docetaxel avesse un effetto molto più marcato nel sottogruppo di pazienti con un alto volume di malattia (sincrono e metacrono), un effetto modesto nei pazienti con tumore a basso volume metacrono e non riscontrando invece un significativo beneficio nell’OS nei pazienti con patologia di basso volume metacrono (4). È importante però considerare che l’associazione del solo Docetaxel all’ADT dovrebbe essere considerata solo se non è disponibile la terapia con ARSI o se coesiste una controindicazione all’assunzione di quelli disponibili e che il rapporto rischi/benefici debba essere chiaramente condiviso con il paziente dopo una attenta valutazione multidisciplinare.
n ulteriore passo avanti nel panorama del trattamento del mHSPC si è avuto grazie allo studio PEACE-1, che ha valutato la somministrazione di una terapia di “tripletta” composta da ADT, Docetaxel e Abiraterone rispetto alla terapia con ADT e Docetaxel. La triplice terapia in tale studio ha mostrato un aumento dell’OS soprattutto nei pazienti con malattia ad alto volume.
Un altro trial di fase III ARASENS ha confrontato l’efficacia della “tripletta” di terapia con ADT + docetaxel + darolutamide rispetto alla classica “doppietta” ADT + docetaxel + placebo, mettendo in evidenza i benefici della tripletta in termini di sopravvivenza, tempo di progressione del dolore, tempo allo sviluppo di malattie resistenti alla castrazione. Questi studi supportano il ruolo dell’aggiunta dell’ARSI nei pazienti in terapia con ADT e Docetaxel principalmente nei pazienti con una malattia metastatica sincrona di alto volume, mentre invece sono necessari ulteriori studi per stabilire il ruolo negli altri sottogruppi clinici (2).
Nella scelta della triplice terapia giocano un ruolo fondamentale la modalità di presentazione della malattia, la qualità della vita del paziente, il profilo di tossicità, il volume della malattia, le comorbidità del paziente, la tossicità dei trattamenti stessi. Pertanto, l’identificazione dei pazienti che possano beneficiare di una terapia di tripletta è cruciale al fine di stabilire il rischio-beneficio derivante da questa triplice associazione. Per tale motivo, questa strategia terapeutica risulta maggiormente indicata nei pazienti per i quali si ipotizza una rapida ed importante evoluzione della sintomatologia, con una rapida trasformazione in CRPC ed una ridotta sopravvivenza.
La radioterapia rappresenta un valido strumento nel trattamento del tumore della prostata. La decisione di utilizzare la radioterapia nell’mHSPC dipende da vari fattori, tra cui l’estensione della malattia e lo stato di salute del paziente. Può essere associata alla terapia ormonale al fine di migliorare i risultati del trattamento con l’obiettivo di trattare il tumore primario della prostata, le metastasi ossee, linfonodali o entrambe. Il razionale di trattare il tumore primitivo nell’ambito di una malattia metastatica è quello di eliminare una potenziale sorgente di nuove metastasi.
Il trial STAMPEDE ha valutato il beneficio dell’aggiunta della radioterapia sul tumore primitivo prostatico in associazione alla terapia sistemica nel paziente metastatico alla diagnosi. Lo studio ha evidenziato che circa l’82% dei pazienti ha ricevuto un beneficio in termini di OS nei pazienti con basso carico di malattia (8).
Anche l’immunoterapia ha suscitato un notevole interesse come opzione terapeutica nell’mHSPC. Inibitori dei checkpoint immunitari come il Pembrolizumab e il Nivolumab mirano a stimolare il sistema immunitario del paziente nei confronti delle cellule tumorali. Tuttavia, nell’mHSPC l’efficacia dell’immunoterapia non è stata ancora completamente definita e sono necessari ulteriori studi clinici.
l trattamento dell’mHSPC richiede un approccio multidisciplinare, integrato e personalizzato, prendendo in considerazione le caratteristiche individuali del paziente, la progressione della malattia ed i potenziali effetti collaterali dei differenti trattamenti. La decisione terapeutica necessita di una discussione condivisa tra il paziente e il medico tenendo conto dei benefici attesi e dei rischi associati a ciascuna opzione terapeutica.
La rapida evoluzione delle terapie nell’mHspc ha portato notevoli miglioramenti nell’OS, soprattutto per quei pazienti che presentano malattia metastatica sincrona ad alto volume associata ad una cattiva prognosi, fornendo loro la possibilità di un durevole controllo della patologia ed una maggiore sopravvivenza. Tuttavia sono necessari ulteriori studi che valutino gli impatti dell’esposizione prolungata degli ARSI nell’ottica di una potenziale de-escalation della terapia.