Farmaci biosimilari dalla teoria alla pratica
Il mito della psoriasi “malattia dei sani” è stato ormai sfatato da tempo. I progressi delle conoscenze hanno chiarito che la psoriasi è una malattia infiammatoria sistemica alla cui patogenesi contribuiscono fattori genetici e immunitari. Le moderne acquisizioni sull’interazione sistema immunitario-fattori ambientali in soggetti geneticamente predisposti, alla base della malattia, consentono di spiegare sia la complessità del trattamento, sia l’andamento cronico recidivante dalla psoriasi.
Secondo le linee guida, la scelta terapeutica è basata sulla gravità della malattia, valutata mediante l’indice PASI (Psoriasis Area and Severity Index), in base al quale la psoriasi è definita lieve (PASI <10), moderata (PASI 10-20) e grave (PASI >20) e sulla presenza di comorbilità (psoriasi artropatica).
Attualmente sono disponibili numerose terapie in grado di rallentare la progressione o anche ottenere significative e prolungate remissioni della malattia. Tipicamente, per il trattamento della psoriasi lieve e localizzata sono utilizzate la fototerapia e la terapia topica, mentre nelle forme moderate-gravi la terapia di prima linea è rappresentata dai farmaci sistemici convenzionali (Disease Modifying Antirheumatic Drugs, DMARD) che includono acitretina, ciclosporina e metotrexato.
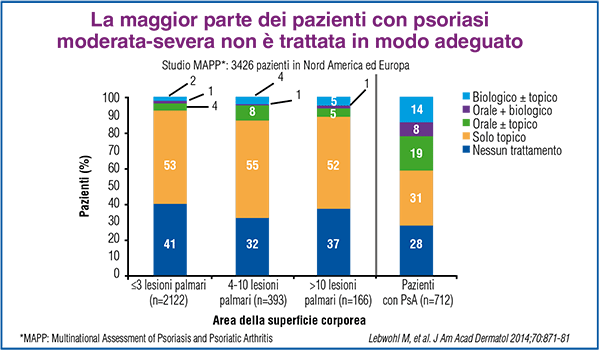
Negli ultimi anni, l’introduzione nella pratica clinica di DMARD biotecnologici (ovvero biologici) ha segnato un importante progresso nel trattamento di diverse patologie infiammatorie in cui è coinvolto il sistema immunitario. Tali agenti terapeutici sono mirati a molecole specifiche che svolgono un ruolo fondamentale nella risposta immune. In particolare, per quanto riguarda le citochine coinvolte nella formazione delle lesioni della psoriasi, alcuni farmaci biologici come adalimumab, infliximab, etanercept inibiscono il TNFα, mentre ustekinumab inibisce le interleuchine IL-12 e IL-23. I farmaci biologici rappresentano un’importante opzione terapeutica nei pazienti che non abbiano risposto o che presentino controindicazioni o intolleranze alle terapie sistemiche tradizionali. Peraltro, la terapia topica continua ad essere il trattamento più utilizzato. A tale riguardo, i risultati di una recente ampia survey condotta negli Stati Uniti e in Europa, a cui hanno partecipato 3426 pazienti, 781 dermatologi e reumatologi, hanno messo in evidenza che la maggior parte dei pazienti affetti da psoriasi di gravità moderata-severa non riceve un adeguato trattamento (Figura 1).
|
Figura 1. Risultati del Population-Based Multinational Assessment of Psoriasis and Psoriatic Arthritis (MAPP) Survey. |
In particolare, nel 52% dei pazienti con psoriasi e nel 31% di quelli con psoriasi artropatica, il trattamento è risultato costituito dalla sola terapia topica, mentre i biologici, in associazione con la terapia topica, sono risultati utilizzati dal 5% e dal 14% dei pazienti, rispettivamente.
Le motivazioni che inducono il medico a non iniziare la terapia sistemica sono differenti per i farmaci sistemici convenzionali e i farmaci biologici. In particolare, per quanto riguarda la terapia convenzionale i fattori limitanti la prescrizione sono rappresentati dalla preoccupazione riguardo la sicurezza e la tollerabilità a lungo termine di tali agenti. Infatti, reazioni avverse importanti sono per il metotrexato l’epatotossicità e per la ciclosporina la tossicità renale, mentre l’acitretina, oltre al rischio di epatotossicità, presenta un effetto teratogeno. Per l’inizio della terapia con i biologici, il fattore limitante è rappresentato dal costo, in quanto quello con i biologici è spesso percepito come un trattamento costoso (Figura 2).
|
Figura 2. Fattori limitanti la prescrizione della terapia sistemica. |
Nell’attuale situazione di limitazione delle risorse economiche, che spinge al contenimento dei costi della sanità, il costo rappresenta una variabile fondamentale da prendere in considerazione nella scelta della terapia, in modo da fare il miglior uso delle risorse disponibili.
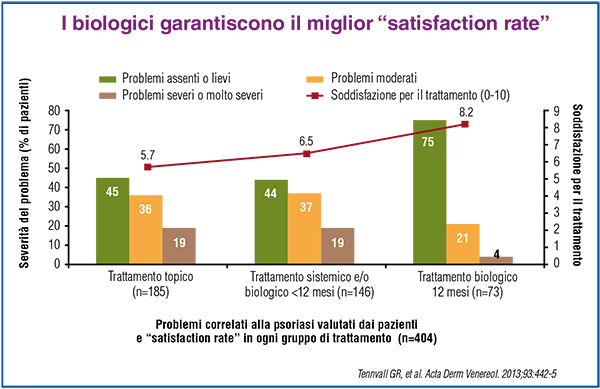
Va considerato, peraltro, che a fronte del maggior costo, i biologici si associano a un miglior satisfaction rate, che si traduce nell’aderenza terapeutica più elevata tra le varie terapie, come dimostrano i risultati di uno studio che ha esaminato qualità della vita, gravità della malattia e soddisfazione per il trattamento di 404 pazienti con psoriasi a placche, di età compresa tra 18 e 75 anni. Lo studio, condotto in Danimarca, Finlandia e Svezia, è stato basato sui dati di una survey di 12 mesi e un’analisi retrospettiva delle cartelle cliniche dei pazienti, che ha identificato tre gruppi di trattamento: topico, sistemico e/o biologico di durata inferiore a 12 mesi e biologico della durata di 12 mesi. Il gruppo di pazienti trattati con i farmaci biologici ha fatto registrare un satisfaction rate pari a 8.2 su una scala in cui 0 indicava completamente insoddisfatto e 10 molto soddisfatto, oltre alla più elevata frequenza (75%) di assenza di psoriasi o psoriasi lieve (Figura 3).
Figura 3. "Satisfaction rate” associato ai vari trattamenti della psoriasi. |
Nonostante la documentata efficacia dei farmaci biologici e la maggiore soddisfazione per il trattamento, in Italia i pazienti trattati con biologici, sulla base dei dati relativi a 57300 pazienti registrati in un centro PSOCARE, rappresentano solo il 3.5% dei potenziali 35000 idonei a tale trattamento.
Una risposta ai bisogni insoddisfatti nella gestione dei pazienti affetti da psoriasi o psoriasi artropatica, come l’adeguatezza del trattamento e la soddisfazione per il trattamento che consente nel contempo di ridurre il costo dei trattamenti, è data dall’introduzione dei biosimilari.
La scadenza brevettuale di vari farmaci biologici impiegati nel trattamento della psoriasi ha, infatti, stimolato l’interesse delle aziende farmaceutiche riguardo allo sviluppo di biosimilari di tali molecole. Attualmente, sono registrati per l’utilizzo in dermatologia due biosimilari di infliximab (Remsima, commercializzato da Mundipharma e Inflectra, commercializzato da Hospira) e sono in varie fasi di sviluppo altri 6 biosimilari di infliximab, 10 biosimilari di etanercept e 11 biosimilari di adalimumab.
L’European Medical Agency (EMA) definisce biosimilare un farmaco biologico sviluppato in modo da risultare simile ad un biologico già autorizzato, che rappresenta il farmaco di riferimento. Biosimilare e farmaco biologico di riferimento possiedono lo stesso principio attivo ma, a causa della natura complessa delle molecole e dei metodi di produzione, potrebbero presentare differenze di minore entità.
Per assicurare che i minimi cambiamenti strutturali eventualmente introdotti non modifichino qualità, efficacia e sicurezza del farmaco biologico di riferimento, gli Enti regolatori richiedono l’esercizio di comparabilità, che prevede tre livelli di indagine successivi: comparazione della qualità (fisico-chimica e biologica), comparazione funzionale non clinica (studi non clinici comparativi) e comparazione clinica.
Quest’ultima prevede la dimostrazione della sovrapponibilità dei parametri farmacocinetici e farmacodinamici di biosimilare e farmaco di riferimento in studi clinici e l’evidenza di un’analoga sicurezza in base agli studi di farmacovigilanza presentati all’EMA.
Come il farmaco di riferimento, il biosimilare mostra un certo grado di variabilità naturale. L’approvazione del biosimilare da parte dell’EMA indica che tale variabilità ed eventuali differenze tra il biosimilare e il suo farmaco di riferimento si sono dimostrate ininfluenti sulla sicurezza e l’efficacia.
Pertanto, un biosimilare può essere considerato clinicamente equivalente al farmaco di riferimento, nonostante eventuali differenze minori nella struttura molecolare, peraltro comparabili con il livello di variabilità inter-lotti evidenziata generalmente tra i diversi lotti del farmaco di riferimento.
Il CT-P13 (Remsima) è il primo infliximab biosimilare autorizzato dall’EMA sulla base di un ampio ed esaustivo esercizio di comparabilità che ne ha dimostrato la similarità al farmaco biologico di riferimento. In particolare, lo sviluppo clinico per dimostrare la biosimilarità di CT-P13 e Remicade è consistito in due studi clinici randomizzati controllati, multicentrici in doppio cieco, in cui sono stati arruolati circa 850 pazienti: lo studio di fase I PLANETAS, condotto su pazienti affetti da spondilite anchilosante, e lo studio di fase III PLANETRA, condotto su pazienti affetti da artrite reumatoide. In entrambi gli studi Remsima ha presentato profili di efficacia e tollerabilità comparabili a quelli di Remicade. Risultati simili sono stati ottenuti anche per quanto riguarda l’immunogenicità, con livelli di anticorpi anti-infliximab comparabili tra Remsima e il farmaco di riferimento.
Sulla base dei risultati degli studi PLANETAS e PLANETRA, CT-P13 è stato autorizzato per il trattamento di artrite reumatoide e spondilite anchilosante; inoltre, dai dati clinici in pazienti con spondilite anchilosante e artrite reumatoide sono estrapolate le indicazioni per il trattamento di psoriasi, artrite psoriasica, malattia di Crohn e colite ulcerosa.
Le indicazioni, peraltro, presentano differenze tra le varie nazioni: in Canada, ad es., CT-P13 è approvato per tutte le indicazioni di Remicade, ad esclusione di rettocolite ulcerosa e malattia di Crohn, nei Paesi europei è approvato per tutte le indicazioni e per gli USA la Arthritis Advisory Committee della FDA ha appena raccomandato l’approvazione per tutte le indicazioni.
Un documento congiunto SIR, SIDeMaST e IG-IBD indica tuttavia la necessità di evidenze dirette su efficacia, sicurezza e immunogenicità dei biosimilari nel trattamento di psoriasi, artropatia psoriasica e malattia infiammatoria intestinale, nonché nei bambini.
Per quanto riguarda lo switch dal biologico di riferimento a Remsima, i risultati di due studi di estensione in aperto, in cui sono stati inclusi i pazienti che hanno completato gli studi PLANETRA e PLANETAS, dimostrano che nei pazienti passati da Remicade a Remsima l’efficacia del trattamento è stata mantenuta ed è risultata sovrapponibile a quella osservata nei pazienti trattati con Remsima per l’intera durata dello studio. Lo switch (intercambiabilità) da farmaco biologico di riferimento a biosimilare potrebbe quindi rappresentare una strategia efficace e sicura, in grado di consentire la riduzione dei costi del trattamento e rendere possibile l’accesso al trattamento di un maggior numero di pazienti.
Le linee guida per lo switch dei vari enti regolatori internazionali, tuttavia, sono differenti; ad esempio, per l’FDA l’intercambiabilità è automatica mentre l’EMA lascia ampia libertà ai vari Paesi europei.
Per quanto riguarda l’indicazione di Remsima nel trattamento della psoriasi, allo scopo di disporre di dati non estrapolati, ma ottenuti direttamente su pazienti affetti da tale condizione, è stato condotto recentemente uno studio italiano.
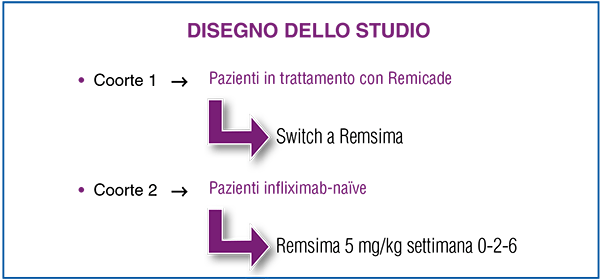
Lo studio ha arruolato 45 pazienti affetti da psoriasi moderata-severa. In base al disegno dello studio, 40 pazienti, 10 dei quali affetti da psoriasi artropatica, sono passati a Remsima dopo un trattamento con Remicade della durata mediana di 237 settimane, mentre gli altri 5, nessuno dei quali affetto da psoriasi artropatica, sono stati trattati con il biosimilare per l’intera durata dello studio (Figura 4).
Figura 4. Disegno dello studio italiano che ha valutato l’utilizzo del biosimilare di infliximab Remsima nel trattamento della psoriasi. |
Per la valutazione cutanea e articolare sono stati utilizzati il punteggio PASI e VAS. Per quanto riguarda la Coorte in cui è stato attuato lo switch, i risultati dimostrano che la remissione di malattia si è mantenuta nella popolazione trattata con il biosimilare: PASI valore medio iniziale: 1.1 –PASI valore medio dopo 6 mesi di follow-up: 1.1. In tale Coorte è stato registrato un unico evento avverso, rappresentato da un episodio di herpes zoster trigeminale (Figura 5).
|
Figura 5. Caratteristiche dei pazienti, trattamento e risultati nella Coorte 1 dello studio italiano che ha valutato l’utilizzo del biosimilare di infliximab Remsima nel trattamento della psoriasi. |
Nella Coorte di pazienti che non avevano seguito alcun precedente trattamento con infliximab, il trattamento con Remsima ha ottenuto un miglioramento del 75% (PASI 75) nell’80% dei pazienti (PASI medio prima di infliximab: 27.3 – PASI medio dopo infusione con biosimilare infliximab: 6.5) e non ha fatto registrare alcun evento avverso (Figura 6).
Figura 6. Caratteristiche dei pazienti, trattamento e risultati nella Coorte 2 dello studio italiano che ha valutato l’utilizzo del biosimilare di infliximab Remsima nel trattamento della psoriasi. |
Questi dati, sebbene ottenuti in un piccolo numero di pazienti e in follow-up di durata limitata (6 mesi), dimostrano che lo switch dei pazienti in trattamento con Remicade a Remsima permette di ottenere risultati comparabili a quelli ottenuti dal farmaco di riferimento. Inoltre, lo studio dimostra che infliximab biosimilare è efficace anche nei pazienti naïve al trattamento con anti-TNFα. In base ai risultati di efficacia e al profilo di sicurezza comparabile al biologico di riferimento dimostrati dallo studio, Remsima si propone come una strategia terapeutica sicura ed efficace nella psoriasi.
|