

Discutere oggigiorno di endometriosi significa parlare di una vera e propria MALATTIA SOCIALE!
L’aumento crescente dei nuovi casi diagnosticati annualmente testimonia come la problematica sia sempre più invadente.
Giusto per citare alcuni dati, ricordiamo che a oggi l’incidenza di malattia si attesta sul 10-15%, che aumenta al 20-30% nelle pazienti con storia d’infertilità, fino a raggiungere il 40-60% se consideriamo il sottogruppo di pazienti che soffrono di dismenorrea (1). In particolare, l’impatto che tale patologia ha sulla sfera riproduttiva femminile è imponente considerando che il 30-50% di pazienti affette da endometriosi soffre d’infertilità (2). I meccanismi attraverso i quali l’endometriosi impatta negativamente sulla fertilità sono molteplici e a vari livelli (Figura 1):
• a livello della pelvi alterando il processo di fertilizzazione;
• a livello ovarico diminuendo la riserva ovarica;
• a livello uterino alterando il processo d’impianto.

Il processo di fertilizzazione viene alterato dallo status infiammatorio pelvico tipico delle pazienti affette da endometriosi. Studi sperimentali hanno dimostrato come nel liquido peritoneale Editoriale si riscontri un elevato livello di citochine proinfiammatorie e fattori di neoangiogenesi e come risulti alterato il processo di fagocitosi macrofagica (3); modificazioni queste che inevitabilmente alterano “l’incontro” tra i due gameti. Nello specifico, sono stati riscontrati livelli aumentati d’interleuchina (IL) 1 e 6 che inficiano negativamente la mobilità spermatica (4), mentre l’aumento del Tumor Necrosis Factor-a (TNF) causa danni al DNA spermatico e diminuisce la capacità di legame alla zona pellucida (5), oltre all’impatto negativo che questo aumento dello stress ossidativo ha sulla capacitazione spermatica (6).
Invece l’influenza negativa dell’endometriosi sulla riserva ovarica si esplica in vari modi, tra cui lo stress ossidativo, di cui abbiamo già accennato, che risulta avere un effetto embriotossico (7) e che altera la qualità ovocitaria (8).
Ciò inevitabilmente ha conseguenze negative, sia in termini di ottenimento della gravidanza, sia in termini di prosecuzione della stessa con un maggior tasso di aborto (9). Inoltre, visto che una delle localizzazioni più frequenti di malattia risulta essere l’ovaio, è frequente il riscontro di cisti che alterano la qualità ovocitaria sia in virtù di quello che è stato definito “effetto massa” - ovvero la compressione del parenchima ovarico “sano” da parte della cisti incriminata -, sia in virtù di un processo flogistico locale innescato dalla cisti stessa (10).
Per quanto concerne l’impatto negativo dell’endometriosi sull’impianto embrionario la ricerca è particolarmente attiva. Uno dei primi meccanismi fisiopatologici ipotizzati alla base di ciò prevede l’abnorme produzione in situ di estrogeni e un effetto “progesteroneresistente” dell’endometrio (11).
Tra le altre ipotesi al vaglio si è ipotizzato un ruolo negativo dell’elevata presenza di immunoglobuline e di linfociti nell’endometrio tale da alterare la ricettività endometriale (12).
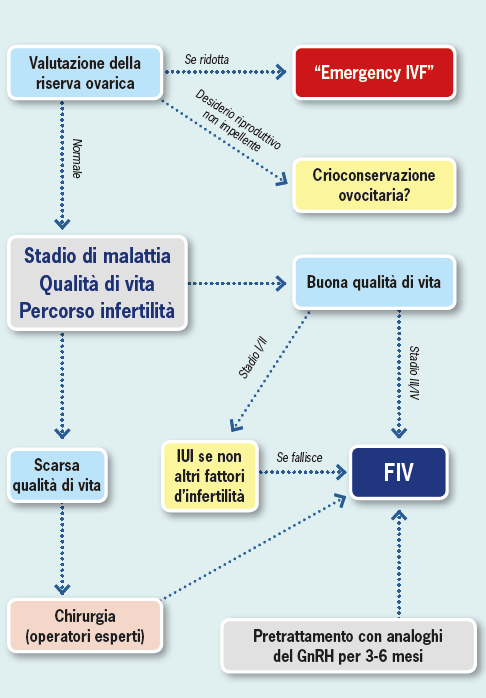
Detto ciò diventa mandatorio mettere in atto e proporre alla paziente le migliori opzioni disponibili nella preservazione della fertilità quando una diagnosi di endometriosi viene fatta o anche solo sospettata. Innanzitutto, una volta posta la diagnosi occorre valutare lo stato di riserva ovarica. Per far ciò non possiamo più limitarci all’utilizzo del solo e classico dosaggio dell’ormone Follicolo Stimolante (FSH) in fase follicolare precoce in quanto poco indicativo dello status qualitativo ovocitario.
Di conseguenza dosare l’ormone anti-mulleriano (AMH) è pratica più che raccomandata in questa tipologia di pazienti. Evidenze scientifiche dimostrano come il valore di tale ormone sia direttamente proporzionale con lo status qualitativo degli ovociti recuperati dopo pick-up e di conseguenza con la qualità degli embrioni ottenuti dopo fertilizzazione (13). Una volta fatto ciò occorre personalizzare al meglio le opzioni terapeutiche, pertanto sarà importante classificare il tipo di endometriosi che affligge la paziente (ovarica, del setto retto-vaginale, adenomiosi) e l’impatto che tale patologia ha sulla sua qualità della vita.
È ovvio che se siamo di fronte ad una paziente con una buona riserva ovarica e una pessima qualità di vita, l’opzione migliore sarà quella di eradicare per quanto possibile la malattia dal punto di vista chirurgico e poi procedere, magari mediante anche tecniche di Procreazione Medicalmente Assistita (PMA), alla ricerca della gravidanza.
Discorso diverso invece è quello delle pazienti con una riserva ovarica già critica per le quali è stato coniato il termine di “emergency IVF” ovvero ricerca immediata della gravidanza con tecniche di PMA di secondo livello allo scopo di non perdere ulteriori “chances” riproduttive. La necessità di modulare attentamente le varie opzioni chirurgiche nasce dalla constatazione che la chirurgia nell’endometriosi (soprattutto ovarica) non è scevra da complicanze soprattutto in termini di paradossale riduzione del patrimonio follicolare.
La capsula della cisti ovarica endometriosica infatti, proprio per il processo infiammatorio che determina intrinsecamente, risulta essere particolarmente adesa alla corticale ovarica, motivo per il quale, durante la sua rimozione può capitare frequentemente di “distruggere” parte del patrimonio follicolare sia per una non corretta enucleazione della capsula stessa, sia per un utilizzo smodato della corrente bipolare. Per tale motivo sono state ideate e confrontate diverse tecniche chirurgiche che vanno dalla vaporizzazione della parete cistica mediante CO2, al semplice drenaggio, alla coagulazione della cisti mediante corrente bipolare fino all’escissione per “stripping” dalla corticale ovarica.
Ad oggi la tecnica più largamente utilizzata, anche perché sembra essere la migliore in termini di “risparmio” di follicoli, risulta essere l’enucleazione della cisti per stripping (14). Ciò nonostante occorre ribadire che il concetto principale deve essere quello di evitare la chirurgia inutile, pertanto endometriomi ovarici “piccoli” (inferiori ai 4 cm) e soprattutto non sintomatici non andrebbero trattati chirurgicamente se l’obiettivo è quello di preservare la fertilità. Per quanto concerne il trattamento medico, l’ideale sarebbe una terapia preventiva. Da un punto di vista fisiopatologico, siccome una delle ipotesi eziopatogenetiche più avvalorate è quella del reflusso tubarico, si è ipotizzato che il trattamento continuativo mediante estroprogestinici possa aiutare (15).
Tuttavia, per perseguire tale obiettivo sarebbe indispensabile una diagnosi precoce, cosa che ancora oggi risulta essere particolarmente difficile (basti pensare che è stato stimato in circa 6 anni il ritardo diagnostico dall’insorgenza dei primi sintomi) e ciò già determina quindi la difficoltà nel selezionare le pazienti che “potrebbero” sviluppare la malattia, ma soprattutto non esistono evidenze tali da supportare l’efficacia di una terapia preventiva. Il risultato è che il più delle volte ci troviamo a trattare pazienti in cui la patologia è già conclamata e dove le opzioni terapeutiche sono limitate obbligando la paziente ad aderire esclusivamente a delle tecniche di PMA. In questo caso, sarà importante lo stadio di malattia e la valutazione globale della coppia perché in alcuni casi permetterà il ricorso a tecniche meno invasive come l’inseminazione intrauterina (IUI), mentre diversamente l’opzione principale sarà rappresentata dalla fecondazione in vitro (FIV). In tal caso, le pazienti beneficerebbero di un pretrattamento con analoghi del GnRH per almeno 3-6 mesi.
A supporto di tale affermazione vi sono diverse evidenze e addirittura due metanalisi della Cochrane, secondo le quali la riduzione dei livelli plasmatici di estradiolo diminuirebbe in maniera sensibile lo status infiammatorio pelvico e darebbe quindi migliori risultati in termine di tasso di gravidanza (16). Altra opzione possibile, almeno in teoria, è rappresentata dalla possibilità di crioconservare tessuto ovarico oppure ovociti. Questa metodica è ipotizzabile ma ancora non unanimamente accettata, e potrebbe essere intrapresa in quelle pazienti in cui viene posta una diagnosi certa di endometriosi e che non hanno un desiderio riproduttivo impellente. C’è però da specificare che si tratta di soluzioni estreme oggi proposte alle pazienti oncologiche prima di effettuare chemioterapia ma che in un futuro potrebbero trovare larga applicazione. Nello specifico dobbiamo però precisare che, mentre la crioconservazione del tessuto ovarico è ancora una metodica ad appannaggio di pochi selezionati centri e ha come obiettivo principale quello di ristabilire principalmente la funzionalità endocrina della donna, la crioconservazione ovocitaria invece è oggi una metodica di largo utilizzo e, certamente, più adatta alle pazienti desiderose di preservare la propria fertilità (17). Da quanto detto diventa fondamentale nella gestione della paziente con endometriosi effettuare un “counselling” e degli accertamenti sulla sfera riproduttiva (Figura 2) e non limitarsi alla sola risoluzione della sintomatologia dolorosa.
Solo così facendo la paziente prenderà coscienza della propria patologia e si potrà realmente fare prevenzione e non essere costretti a scelte terapeutiche obbligate poco accettate (come la FIV) e che non garantiscono i risultati sperati.
1. Kvaskoff M, Mu F, Terry KL et al. Endometriosis: a high-risk population for major chronic diseases? Hum Reprod Update. 2015; 21(4):500-16.
2. Barbosa MA, Teixeira DM, Navarro PA et al. Impact of endometriosis and its staging on assisted reproduction outcome: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2014; 44(3):261-78.
3. Polak G, Wertel I, Barczyn´ski B et al. Increased levels of oxidative stress markers in the peritoneal fluid of women with endometriosis. Eur J Obstet Gynecol Reprod Biol. 2013; 168(2):187-90.
4. Yoshida S, Harada T, Iwabe T et al. A combination of interleukin-6 and its soluble receptor impairs sperm motility: implications in infertility associated with endometriosis. Hum Reprod. 2004; 19(8):1821-5.
5. Perdichizzi A, Nicoletti F, La Vignera S et al. Effects of tumour necrosis factor-alpha on human sperm motility and apoptosis. J Clin Immunol. 2007; 27(2):152-62.
6. Botha DJ, Kruger TF, Van Der Merwe JP et al. Semen profiles of male partners in females presenting with endometriosis-associated subfertility. Fertil Steril. 2009; 91(6):2477-80.
7. Gómez-Torres MJ, Acién P et al. Embryotoxicity of peritoneal fluid in women with endometriosis. Its relation with cytokines and lymphocyte populations. Hum Reprod. 2002; 17(3):777-81.
8. Saito H, Seino T, Kaneko T et al. Endometriosis and oocyte quality. Gynecol Obstet Invest. 2002; 53 Suppl 1:46-51.
9. Hamdan M, Omar SZ, Dunselman G et al. Influence of endometriosis on assisted reproductive technology outcomes: a systematic review and meta-analysis. Obstet Gynecol. 2015; 125(1):79-88.
10. Taylor RN, Yu J, Torres PB et al. Mechanistic and therapeutic implications of angiogenesis in endometriosis. Reprod Sci. 2009; 16(2):140-6.
11. Lessey BA, Young SL. Homeostasis imbalance in the endometrium of women with implantation defects: the role of estrogen and progesterone. Semin Reprod Med. 2014; 32(5):365-75.
12. Osuga Y, Koga K, Hirota Y et al. Lymphocytes in endometriosis. Am J Reprod Immunol. 2011; 65(1):1-10.
13. Dewailly D, Andersen CY, Balen A et al. The physiology and clinical utility of anti-Mullerian hormone in women.Hum Reprod Update. 2014; 20(3):370-85.
14. Muzii L, Achilli C, Bergamini V et al. Comparison between the stripping technique and the combined excisional/ablative technique for the treatment of bilateral ovarian endometriomas: a multicentre RCT. Hum Reprod. 2016; 31(2):339-44.
15. Vercellini P, Viganò P, Somigliana E et al.Endometriosis: pathogenesis and treatment. Nat Rev Endocrinol. 2014;10(5):261-75.
16. Sallam HN, Garcia-Velasco JA, Dias S et al. Long-term pituitary down-regulation before in vitro fertilization (IVF) for women with endometriosis. Cochrane Database Syst Rev. 2006; 25(1):CD004635.
17. Somigliana E, Viganò P, Filippi F et al. Fertility preservation in women with endometriosis: for all, for some, for none? Hum Reprod. 2015; 30(6):1280-6.