


MSD Salute è il portale di riferimento per il professionista della salute su cui il Farmacista può trovare informazioni e contenuti di carattere pratico, in grado di fornirgli un valido supporto nella sua attività quotidiana di consulente della salute.
Allergie dermatologiche e respiratorie: incroci e profili comuni
Introduzione: un secolo di atopia
Una delle problematiche più interessanti e dibattute nel campo delle allergie riguarda l’inquadramento fisiopatologico delle varie sindromi cliniche. A partire dalle prime evidenze scientifiche acquisite, è emerso il dato che le diverse manifestazioni hanno un substrato comune, tanto da indurre gli esperti a coniare, ormai quasi un secolo fa, il termine “atopia” per designare il fenomeno dell’ipersensibilizzazione alla base di tutti i diversi quadri clinici che vanno sotto il nome di reazioni allergiche (1).
I primi ricercatori indagarono a fondo l’atopia evidenziandone diversi aspetti fondamentali ma introducendo anche molte curiose speculazioni (2). Le ricerche succedutesi nel corso dei decenni successivi hanno dimostrato, via via, la correlazione tra atopia e malattie allergiche (asma, febbre da fieno, rinite perenne, dermatite atopica, allergie alimentari del lattante) (3, 4), aumento delle IgE nel sangue e incremento delle IgE per specifici allergeni ambientali (5-8). Il campo delle allergie ha visto un rapido sviluppo di conoscenze e applicazioni pratiche alla fine degli anni ’50.
La classica nomenclatura di Gell e Coomb delle reazioni allergiche (i noti tipi 1-4 di ipersensibilità) è stata a lungo usata, anche se il ruolo reciprocamente esclusivo di anticorpi e cellule immunocompetenti è stato indebitamente enfatizzato (9). Questa dicotomia, infatti, non è più in linea con le conoscenze attuali che suggeriscono piuttosto una risposta immune dinamica, coordinata dall’attività delle cellule dendritiche e dei linfociti Th e mediata da diversi tipi di cellule effettrici e dalle attività di anticorpi, chemochine e citochine (9).
Alla metà degli ’70, per le reazioni allergiche classiche IgE-mediate fu coniata la definizione di “allergia atopica” (10). Ancora oggi il termine “atopico” è spesso usato come sinonimo di “IgE-mediato”, mentre alcuni Autori gli conferiscono una valenza squisitamente clinica, per designare quadri allergici connotati da un accentuato carattere di familiarità.
La revisione della nomenclatura delle allergie: l’EAACI Position Paper 2001
Nel tentativo di mettere ordine nell’ampio spettro di teorie e opinioni sulla patologia allergica una Task force dell’European Academy of Allergy and Clinical Immunology (EAACI) ha pubblicato qualche anno fa un position paper allo scopo di proporre una nomenclatura aggiornata delle reazioni allergiche basata sulle conoscenze più aggiornate in questo campo (9).
Gli esperti dell’EAACI hanno riformulato una definizione di atopia in termini di tendenza personale o familiare a produrre anticorpi IgE in risposta a basse dosi di allergeni, di solito proteici, e a sviluppare sintomi clinici, quali asma, rinocongiuntivite o eczemi e dermatiti (9).
Secondo la proposta degli allergologi europei, i termini “atopia” e “atopico” devono essere utilizzati per indicare questa “predisposizione” e non per descrivere entità nosologiche definite.
L’atopia sarebbe, dunque, una tendenza a sviluppare determinati quadri clinici su reattiva allergica. In un individuo tipicamente “atopico”, nella prima infanzia si possono manifestare sindromi, quali diarrea, rash cutanei, sibili respiratori (9) che possono essere a ragione etichettati come “atopici”: si può ad esempio parlare di asma atopico. Al contrario, secondo la Task force dell’EAACI, l’asma IgE-mediato non deve essere etichettato come “asma atopico”, al di fuori di una condizione di atopia, come sopra definita. Lo stesso vale per le altre manifestazioni cliniche (9).
Su tali premesse è nato e si è affermato di recente il concetto di “marcia atopica” che di seguito tratteremo.
Incroci e profili comuni tra allergie cutanee e respiratorie: la marcia atopica
Il concetto di marcia atopica è stato sviluppato per descrivere la progressione dei disturbi atopici, dalla dermatite atopica (AD) nei neonati, alla rinite allergica e asma nei bambini e negli adulti (11).
I pazienti affetti da AD possono sviluppare una tipica sequenza di AD → rinite allergica → asma nel corso degli anni (12).
L’atopia, come già detto, deve essere intesa come una predisposizione individuale o familiare alla produzione di anticorpi IgE e alla sensibilizzazione in risposta a trigger ambientali (13) ed è considerata come un fattore critico nel collegamento tra AD, rinite e asma (Figura 1) (11, 14).
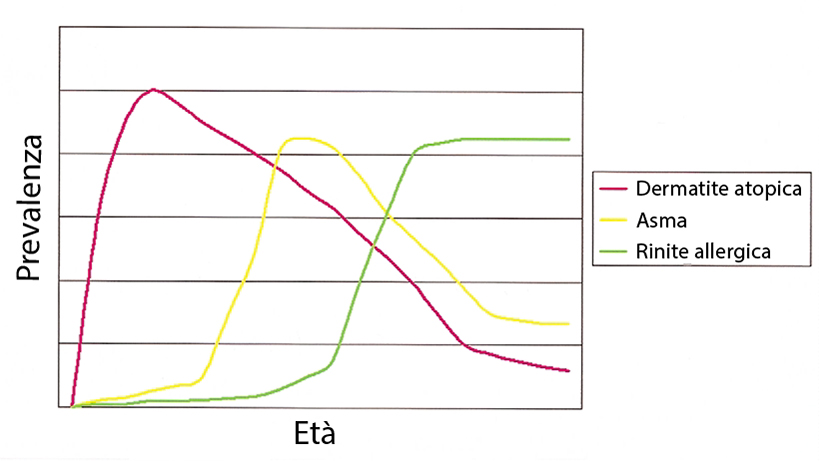
Figura 1. Prevalenza dei vari disordini atopici. Figura 4 di (11)
La dermatite atopica è una malattia cutanea pruriginosa cronica.
Nell’ International Study of Asthma and Allergies in Childhood (ISAAC), la prevalenza di AD nei bambini varia significativamente dallo 0,3% al 20,5% in 56 Paesi, ma vi è una tendenza generale all’aumento della prevalenza della malattia nel tempo (15, 16).
In molti studi, l’AD è stata considerata come il primo passo della marcia atopica. Sembra che i bambini con eczema abbiano una probabilità triplicata di sviluppare asma e/o rinite al follow-up a 5 anni, rispetto ai bambini che non hanno eczema.
Nei casi di eczema grave, eczema a esordio precoce ed eczema persistente, il rischio di sviluppare asma e rinite aumenta ulteriormente (17).
Il Tasmanian Longitudinal Health (TLH) Study ha evidenziato che l'eczema infantile è significativamente associato all'insorgenza di asma nella pre-adolescenza, nell’adolescenza, nella vita adulta, nonché nel corso dell’intera esistenza (tra gli 8 anni e i 44 anni della popolazione di studio) (Figura 2) (18).

Figura 2. Probabilità di sviluppare asma in differenti fasi della vita correlato all’eczema infantile. Tabella II di (18)
È nota da tempo la forte associazione tra rinite e asma allergici, corroborata dagli studi epidemiologici che suggeriscono che la rinite allergica è un fattore di rischio per asma e può precedere l'asma nella marcia atopica (19-23).
Ruolo dell’allergia alimentare nella marcia atopica
Dermatite atopica e allergia alimentare frequentemente coesistono, in particolare nei soggetti affetti da eczema atopico ad esordio precoce, grave e persistente (28).
L'allergia alimentare è un noto fattore scatenante l’AD e la prevalenza di allergia alimentare IgE-mediata è circa del 35% nei bambini affetti da AD (24).
Non è del tutto chiaro se i bambini con allergia alimentare IgE-mediata siano a maggior rischio di sviluppare altre successive manifestazioni allergiche come l'asma e la rinite allergica.
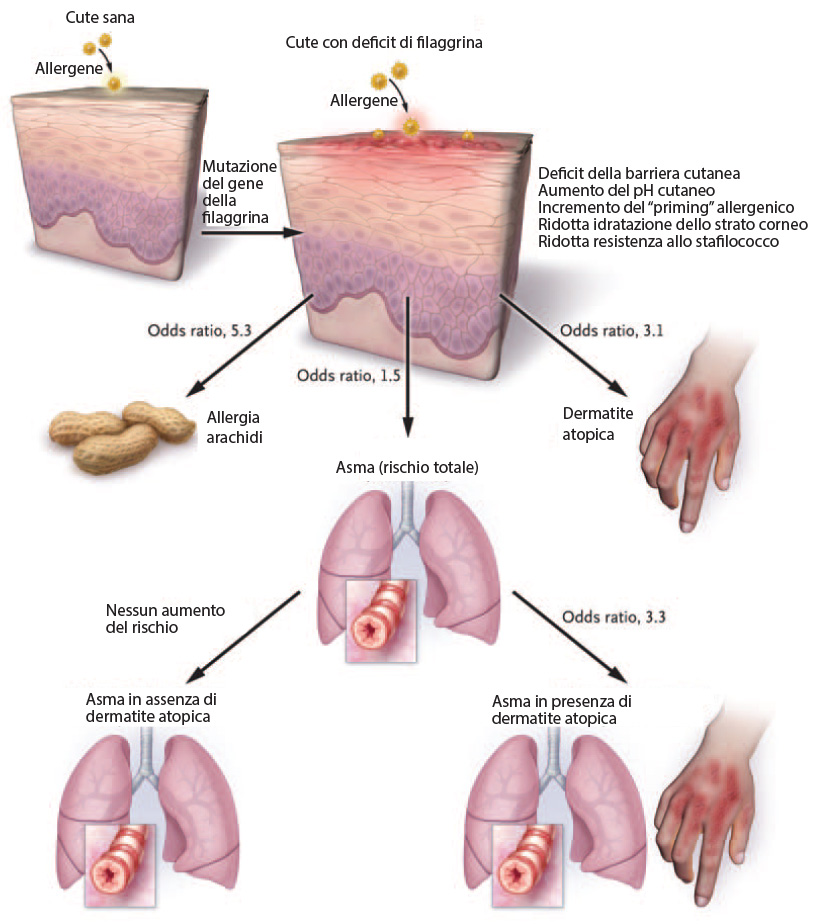
Uno studio ha dimostrato che la precoce sensibilizzazione al cibo e la presenza di una mutazione della filaggrina (vedi in seguito, per questo importante componente dei tessuti cutanei) nei neonati con eczema ad esordio precoce aumenta il rischio di sviluppare eczema persistente e successivamente asma (25).
L’allergia al latte vaccino (CMA) nella prima infanzia predispone i bambini allo sviluppo di iperreattività bronchiale in età scolastica (26, 27).
Non è chiaro se la progressione dall’allergia alimentare IgE-mediata all'asma nei soggetti senza eczema sia l’esito di un rapporto causa-effetto o sia il risultato di fattori ambientali e/o genetici in comune.
Potenziali meccanismi ed ipotesi alla base della marcia atopica
L'epidermide ha un ruolo essenziale nel garantire l’integrità della barriera cutanea. La formazione di questa barriera, infatti, è dovuta in gran parte ai cheratinociti, un tipo di cellule epiteliali, che sostituiscono la loro membrana plasmatica con uno strato resistente e insolubile, il cosiddetto strato corneo, per creare e mantenere appunto questa barriera allo scopo di evitare l’ingresso nel corpo di agenti infettivi ed allergeni.
La perdita dell’integrità di questa barriera cutanea è senza dubbio un momento importante che dà il via al processo di sensibilizzazione allergica (28). È opinione comune degli esperti che l’esposizione all’allergene a causa di una barriera cutanea compromessa innesca una reazione allergica di carattere sistemico e predispone le persone a sviluppare AD, rinite allergica e asma (28).
Difetti della barriera cutanea nell’AD e marcia atopica
Ma da cosa dipende la compromissione della barriera cutanea?
La funzione della barriera cutanea è compromessa nella dermatite atopica a causa di molteplici anomalie, prevalentemente di tipo costituzionale, tra le quali, una carenza di lipidi cutanei (ceramide e sfingosina) e un’alterata cheratinizzazione (cioè formazione dello strato corneo) dovuta ad un difetto della già citata filaggrina, una componente molto importante nella struttura dello strato corneo (29-34).
La filaggrina e la sua importanza per la cute
La filaggrina è una proteina presente nello strato corneo dell’epidermide dove ha la funzione di aggregare i filamenti di cheratina. Di recente è stata dimostrata una correlazione tra la dermatite atopica e l’assenza o riduzione di questa proteina che determinerebbe le alterazioni della barriera cutanea, uno dei fattori principali presenti nella patogenesi della dermatite atopica e all’origine della marcia atopica.
Irvine A et al. N Engl J Med 2011;365:1315-27.
Nella dermatite atopica, la barriera cutanea alterata predispone i pazienti a sviluppare infezioni precoci e sensibilizzazione allergica. In questi soggetti predisposti, la mancata efficienza della barriera cutanea fa sì che quando gli allergeni vengono catturati dalle cellule epidermiche migrano nei linfonodi e interagiscono con i linfociti T, innescando lo sviluppo di allergie sistemiche (Figura 3) (11, 32).
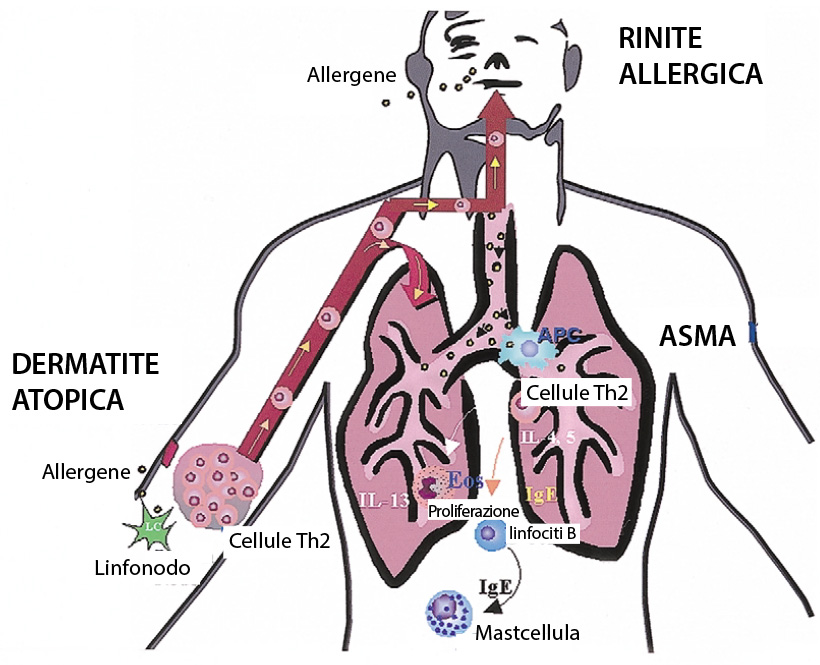
Figura 3. La sensibilizzazione cutanea in seguito ad esposizone ad un allergene innesca una risposta immunitaria sistemica (11)
Molte evidenze dimostrano che la conseguente sensibilizzazione nei confronti di aeroallergeni si associa in questi pazienti allo sviluppo di asma (35).
Ruolo della mutazione della filaggrina nell’AD e nella marcia atopica
Diversi studi genetici sostengono fortemente il ruolo della filaggrina nella genesi di AD e nella successiva progressione nella marcia atopica (36).
Le mutazioni dei geni della filaggrina sono attualmente considerate uno dei più importanti fattori di rischio per AD, in particolare nei pazienti con esordio di AD all’ età ≤2 anni (37).
È stato dimostrato che le mutazioni del gene della filaggrina si associano all’incidenza di asma e rinite allergica ed è molto interessante notare come questa associazione si osservi solo nei soggetti con precedenti di dermatite atopica (33).
Evidenze sperimentali supportano l’ipotesi che la penetrazione transcutanea dell’allergene conduce ad una risposta atopica sistemica (38, 39). Il fatto che l’asma si osservi solo in un sottogruppo di portatori di mutazioni della filaggrina con AD supporta l’ipotesi, secondo cui, l’asma è secondario alla sensibilizzazione allergica che si verifica dopo compromissione della barriera cutanea epidermica. Mutazioni della filaggrina potrebbero svolgere un ruolo nella cronicità della malattia e della sensibilizzazione delle IgE nei pazienti affetti da AD.
DAI MECCANISMI FISIOPATOLOGICI ALLA TERAPIA: IL RUOLO DEGLI ANTISTAMINICI E DEI CORTICOSTEROIDI NEL TRATTAMENTO DELLE ALLERGIE
ANTISTAMINICI. L’istamina è un mediatore chimico contenuto nelle mastcellule e nei basofili. Viene rilasciata da queste cellule in risposta a vari stimoli (immunologici e non) e svolge le sue attività attraverso il legame a recettori specifici. L’istamina endogena è il principale mediatore della risposta allergica. Gli antistaminici sono farmaci in grado di modulare i recettori dell’istamina e costituiscono, pertanto, un’opzione terapeutica essenziale nel trattamento delle patologie istamino-mediate, come appunto le allergie (40). Gli antistaminici – H1 antagonisti, come ad esempio la desloratadina, bloccano selettivamente i recettori H1 periferici dell’istamina. Hanno dimostrato di avere spiccate proprietà antiallergiche (inibizione del rilascio di citochine pro-infiammatorie quali IL-4, IL-6, IL-8 e IL-13 da mastociti, basofili umani, inibizione dell’espressione della molecola di adesione P-selectina sulle cellule endoteliali). In seguito alle evidenze riportate in molti studi, gli antistaminici, come desloratadina, sono indicati nel trattamento della rinite allergica, dell’orticaria (41) e di altre manifestazioni cliniche allergiche mediate dall’istamina (40, 41).
CORTICOSTEROIDI. Un’altra classe di farmaci efficace nel trattamento delle allergie è quella dei corticosteroidi, che possono essere impiegati per via sistemica o topica. Numerosi corticosteroidi topici, come ad esempio il mometasone furoato, hanno dimostrato notevoli proprietà antinfiammatorie locali a dosi che non sono attive a livello sistemico. È probabile che gli effetti antiallergici e antinfiammatori del mometasone furoato siano correlati alla sua capacità di inibire il rilascio dei mediatori delle reazioni allergiche.
Il mometasone furoato inibisce significativamente il rilascio dei leucotrieni dai leucociti di pazienti allergici. Lo spray nasale a base di mometasone furoato ha dimostrato attività antinfiammatoria sia nelle fasi precoci che in quelle tardive delle risposte allergiche (riduzione dell’attività istaminica ed eosinofila e la riduzione di eosinofili, neutrofili e di proteine di adesione della cellula epiteliale) ed è molto efficace nel trattamento delle riniti allergiche sia stagionali che perenni (42).
Conclusioni
Diverse evidenze (studi clinici, genetici e sperimentali) suggeriscono che la precedente manifestazione di AD è un prerequisito per lo sviluppo di rinite allergica, asma e sensibilizzazioni specifiche, evidenziando l’importanza della barriera cutanea disfunzionale nella patogenesi di questi disturbi. Non è del tutto chiaro se la AD sia necessaria nella marcia atopica alla progressione verso altri disturbi atopici. Per stabilire un nesso causale tra AD e malattie allergiche respiratorie sono ancora necessari studi sui meccanismi immunologici alla base dell’associazione e studi clinici che dimostrino che l’intervento terapeutico, nei confronti della AD, riduce la successiva incidenza di asma. È inoltre, importante, identificare i neonati a rischio per lo sviluppo di malattie atopiche croniche nel corso della vita e sfruttare la “finestra” temporale in cui è possibile intervenire precocemente cercando di arrestare la “marcia atopica” al suo esordio intervenendo sulle manifestazioni cutanee. La terapia mirata al mantenimento e alla riparazione della barriera epidermica nei neonati con AD potrebbe essere utile a prevenire il successivo sviluppo di asma.
È tutto ancora da confermare, ma i dati qui esposti rappresentano le numerose evidenze a sostegno di questa tesi.

Medicinale soggetto a prescrizione medica (RR)
Classe A - Nota 89. Prezzo al pubblico: 20 compresse 5mg €6,53
Classe C Prezzo al pubblico: 7 compresse 5mg €6,80
Classe C Prezzo al pubblico: fl. da 100ml - 0,5 mg/ml €16,90
Classe C Prezzo al pubblico: 18 cpr orodispersibili da 2,5 mg €15,00; 30 cpr orodispersibili da 2,5 mg €21,80

Medicinale soggetto a prescrizione medica (RR)
Classe C
Prezzo al pubblico: Spray nasale 60 dosi €16,90; Spray nasale 140 dosi €25,50
Bibliografia
1. Coca AF, Cooke RA. On the classification of the phenomena of hypersensitiveness. J Immunol 1923; 8:163–182.
2. Coca AF, Grove EF. Studies in hypersensitiveness. XIII. A study of the atopic reagins. J Immunol 1925; 10: 445–464.
3. Musgrove K, Morgan JK. Infantile eczema: a long-term follow-up study. Br J Dermatol 1967; 95:365–372.
4. Stifler WC. A 21-year follow-up of infantile eczema. J Pediatr 1965; 66:166–169.
5. Juhlin L, Johansson SGO, Bennich H et al. Immunoglobulin E in dermatoses: levels in atopic dermatitis and urticaria. Arch Dermatol 1969; 100:12–16.
6. Ogawa M, Berger PA, Mcintyre OR et al. IgE in atopic dermatitis. Arch Dermatol 1971; 103:575–580.
7. Wuthrich B. Allergen-spezifische IgE im Radio-Allergo-Sorbens-Test bei Neurodermitis. Hautarzt 1974; 25:603–605.
8. Ohman S, Johansson SGO. Allergen specific IgE in atopic dermatitis. Acta Derm Venereol (Stock) 1974; 55:283–290.
9. Johansson SGO et al. A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force. Allergy 2001; 56:813–824.
10. Pepys J. Atopy. In: GILL PGH, Coombs RRA, Lachmann PJ, editors. Clinical aspects of immunology. 3rd ed. Oxford: Blackwell Scientific, 1975: 877–902.
11. Spergel JM Paller AS. Atopic dermatitis and the atopic march. J Allergy Clin Immunol. 2003; 112:S118–S127.
12. Spergel JM. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin North Am. 2010; 30:269–280.
13. Johansson SG, Bieber T, Dahl R et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol. 2004; 113:832–836.
14. Spergel JM. Atopic march: link to upper airways. Curr Opin Allergy Clin Immunol. 2005; 5:17–21.
15. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet. 1998; 351:1225–1232. [No authors listed]. [PubMed: 9643741]
16. Asher MI, Montefort S, Björkstén B et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet. 2006; 368:733–743.
17. von Kobyletzki LB, Bornehag CG, Hasselgren M et al. Eczema in early childhood is strongly associated with the development of asthma and rhinitis in a prospective cohort. BMC Dermatol. 2012; 12:11.
18. Burgess JA, Dharmage SC, Byrnes GB et al. Childhood eczema and asthma incidence and persistence: a cohort study from childhood to middle age. J Allergy Clin Immunol. 2008; 122:280–285.
19. Bugiani M, Carosso A, Migliore E et al. Allergic rhinitis and asthma comorbidity in a survey of young adults in Italy. Allergy. 2005; 60:165–170.
20. Burgess JA, Walters EH, Byrnes GB et al. Childhood allergic rhinitis predicts asthma incidence and persistence to middle age: a longitudinal study. J Allergy Clin Immunol. 2007; 120:863–869.
21. Guerra S, Sherrill DL, Martinez FD et al. Rhinitis as an independent risk factor for adult-onset asthma. J Allergy Clin Immunol. 2002; 109:419–425.
22. Leynaert B, Neukirch C, Kony S et al. Association between asthma and rhinitis according to atopic sensitization in a population-based study. J Allergy Clin Immunol. 2004; 113:86–93.
23. Shaaban R, Zureik M, Soussan D et al. Rhinitis and onset of asthma: a longitudinal population-based study. Lancet. 2008; 372:1049–1057.
24. Eigenmann PA, Sicherer SH, Borkowski TA et al. Prevalence of IgE-mediated food allergy among children with atopic dermatitis. Pediatrics. 1998; 101:E8.
25. Filipiak-Pittroff B, Schnopp C, Berdel D et al. Predictive value of food sensitization and filaggrin mutations in children with eczema. J Allergy Clin Immunol. 2011; 128:1235–1241.
26. Saarinen KM, Pelkonen AS, Mäkelä MJ et al. Clinical course and prognosis of cow's milk allergy are dependent on milk-specific IgE status. J Allergy Clin Immunol. 2005; 116:869–875.
27. Malmberg LP, Saarinen KM, Pelkonen AS et al. Cow's milk allergy as a predictor of bronchial hyperresponsiveness and airway inflammation at school age. Clin Exp Allergy. 2010; 40:1491–1497
28. Bantz SK, Zhu Z, Zheng T. The Atopic March: Progression from Atopic Dermatitis to Allergic Rhinitis and Asthma. J Clin Cell Immunol. 2014 April; 5(2).
29. Arikawa J, Ishibashi M, Kawashima M et al. Decreased levels of sphingosine, a natural antimicrobial agent, may be associated with vulnerability of the stratum corneum from patients with atopic dermatitis to colonization by Staphylococcus aureus. J Invest Dermatol. 2002; 119:433–439.
30. Illi S, von Mutius E, Lau S et al. The natural course of atopic dermatitis from birth to age 7 years and the association with asthma. J Allergy Clin Immunol. 2004; 113:925–931.
31. Kissling S, Wüthrich B. [Follow-up of atopic dermatitis after early childhood]. Hautarzt. 1993; 44:569–573.
32. McGrath JA, Uitto J. The filaggrin story: novel insights into skinbarrier function and disease. Trends Mol Med. 2008; 14:20–27.
33. Palmer CN, Irvine AD, Terron-Kwiatkowski A et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat Genet. 2006; 38:441–446.
34. Werner Y, Lindberg M. Transepidermal water loss in dry and clinically normal skin in patients with atopic dermatitis. Acta Derm Venereol. 1985; 65:102–105.
35. Lodge CJ, Lowe AJ, Gurrin LC et al. House dust mite sensitization in toddlers predicts current wheeze at age 12 years. J Allergy Clin Immunol. 2011; 128:782–788.
36. Marenholz I, Nickel R, Rüschendorf F et al. Filaggrin loss-of-function mutations predispose to phenotypes involved in the atopic march. J Allergy Clin Immunol. 2006; 118:866–871. ]
37. Stemmler S, Parwez Q, Petrasch-Parwez E et al. Two common loss-of-function mutations within the filaggrin gene predispose for early onset of atopic dermatitis. J Invest Dermatol. 2007; 127:722–724.
38. Fallon PG, Sasaki T, Sandilands A et al. A homozygous frameshift mutation in the mouse Flg gene facilitates enhanced percutaneous allergen priming. Nat Genet. 2009; 41:602–608.
39. Oyoshi MK, Murphy GF, Geha RS. Filaggrin-deficient mice exhibit TH17-dominated skin inflammation and permissiveness to epicutaneous sensitization with protein antigen. J Allergy Clin Immunol. 2009; 124:485–493. 493.
40. Marseglia GL et al. Gli antistaminici – Rivista di Immunologia e allergologia pediatrica 2016 (1); 3-12
41. RCP Desloratadina.
42. RCP Mometasone furoato.