

Il carcinoma uroteliale (UC) è il quarto tumore maligno più comune negli uomini e il dodicesimo tumore maligno più comune nelle donne, con un’incidenza di circa 80470 nuovi casi e 17670 decessi nel 2020 negli Stati Uniti. I tumori vescicali rappresentano la localizzazione più comune dei tumori della via escretrice (90-95% dei carcinomi uroteliali), mentre i tumori della pelvi renale e dell’uretere (UTUC) sono poco comuni e comprendono dal 5% al 10% di tutte le neoplasie uroteliali. Tra gli UTUC, i tumori pielocaliceali sono circa due volte più comuni di quelli che interessano esclusivamente l’uretere, mentre i tumori multifocali si riscontrano in circa il 10-20% dei casi. Nel 17% dei casi, l’UTUC è associato ad una neoplasia vescicale concomitante, mentre nel 41% dei casi si riscontra un’anamnesi precedente di tumore vescicale. Circa due terzi dei pazienti che presentano UTUC hanno una malattia invasiva alla diagnosi, rispetto al 15-25% dei pazienti che presentano un tumore vescicale muscolo-invasivo. La diagnosi di UTUC può essere incidentale o secondaria a sintomi. Il sintomo più comune è l’ematuria macro o microscopica (70-80%). Il dolore al fianco, dovuto all’ostruzione da parte di un coagulo del tessuto tumorale stesso si verifica in circa il 20-32% dei casi. I sintomi sistemici (tra cui anoressia, perdita di peso, malessere, affaticamento, febbre, sudorazione notturna o tosse) associati all’UTUC dovrebbero indurre a valutare la presenza di metastasi, associate a una prognosi peggiore. Poiché la stadiazione clinica dell’UTUC risulta complessa, è stato necessario stratificare, in base alle caratteristiche della neoplasia, il rischio di progressione, suddividendo l’UTUC in basso e alto rischio (Figura 1).
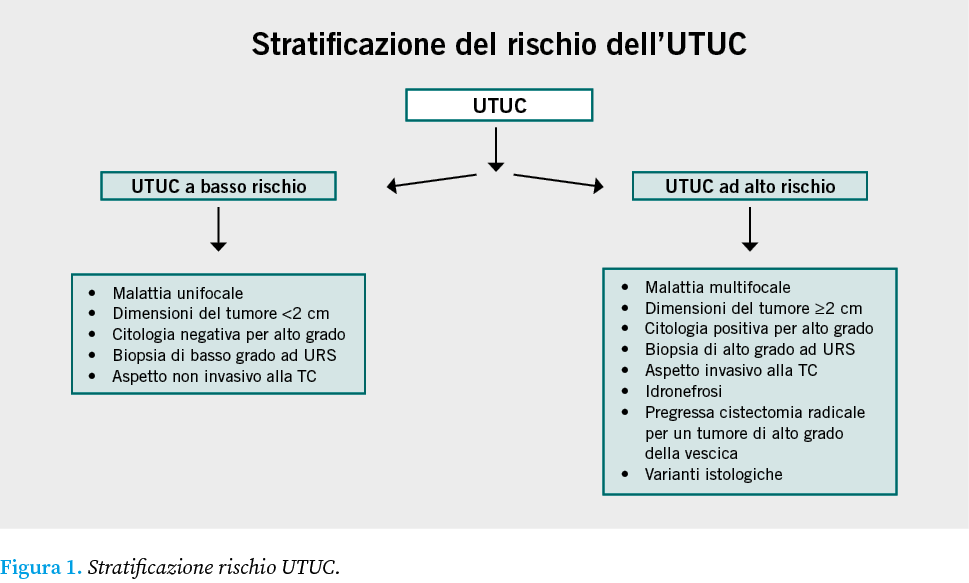
A causa della sua bassa
incidenza e della mancanza di dati prospettici randomizzati, nella pratica clinica, la gestione dell’UTUC viene erroneamente uniformata alla gestione della neoplasia vescicale. Le Linee guida internazionali suggeriscono invece che, mentre lo standard di cura per i pazienti con UTUC localizzato ad alto rischio consiste nell’intervento chirurgico di nefroureterectomia radicale con resezione della cuffia vescicale e linfadenectomia loco-regionale, per la malattia localizzata non metastatica a basso rischio, può essere proposta la chirurgia kidney-sparing (come l’ablazione endoscopica e la resezione ureterale segmentaria con margini ampi), che riduce la morbidità associata alla chirurgia radicale, senza compromettere gli <1>outcome oncologici. Tuttavia, nonostante la radicalità dell’approccio chirurgico, vista l’aggressività biologica dell’UTUC ad alto rischio, gli <1>outcome oncologici spesso rimangono sfavorevoli.
I pazienti spesso sviluppano recidiva locale o metastatica con tassi di ricorrenza riportati del 22-66% e sopravvivenza cancro-specifica a 5 anni inferiore al 50% per i pazienti con UTUC avanzato. Negli ultimi anni diversi studi hanno valutato il ruolo della terapia neoadiuvante/adiuvante a base di platino per l’UTUC localizzato ad alto rischio. Lo studio POUT, uno studio randomizzato di fase 3, ha riportato dati che dimostrano un miglioramento della sopravvivenza libera da progressione nell’UTUC trattato con 4 cicli di gemcitabina/cisplatino adiuvante rispetto alla sola sorveglianza. Infatti, la maggior parte delle recidive di UTUC si verifica entro i primi 3 anni dalla resezione e il 61% di queste recidive si verifica in siti distanti. Il polmone è il sito più comune, seguito da fegato e osso. La terapia sistemica con chemioterapia e, più recentemente, con gli inhibitor checkpoint, è considerata il pilastro del trattamento per la maggior parte dei pazienti con malattia metastatica.
I regimi di chemioterapia combinata a base di cisplatino, come metotrexato, vinblastina, doxorubicina e cisplatino (MVAC) o gemcitabina/cisplatino, continuano a rappresentare il gold standard per i pazienti con malattia metastatica in prima linea. Tuttavia, la progressione della malattia è spesso inevitabile, e le remissioni a lungo termine sono descritte solo in circa il 10% dei pazienti. Inoltre nella pratica clinica, fino a due terzi dei pazienti affetti da UTUC risultano non idonei alla somministrazione di cisplatino, a causa di un performance status compromesso o di multiple comorbidità. In questi pazienti, oggi abbiamo diverse opzioni, quali l’atezolizumab, inibitore della PDL-1, e il pembrolizumab, inibitore del PD1, che hanno ottenuto l’approvazione nel trattamento di prima linea nei pazienti risultati <1>unfit per il platino. In particolare, tra il 2014 e il 2015, è stato condotto lo studio IMvigor210, studio multicentrico, a braccio singolo, di fase 2, in cui i pazienti hanno ricevuto una o più dosi di atezolizumab. Tale studio ha evidenziato un tasso di risposta obiettiva (ORR, la proporzione di pazienti che hanno ottenuto una risposta completa o parziale) del 23% e l’overall survival mediana è stata di 15.9 mesi nella popolazione complessiva. Nonostante il disegno dello studio sia a braccio singolo, la OS mediana di 15.9 mesi è comunque degna di nota se confrontata con la prima linea di gemcitabina-carboplatino (9.3 mesi) o con regimi a base di cisplatino nei pazienti eleggibili (15.3 mesi). Tra il 2015 e il 2016 è stato portato a termine un ulteriore studio, il KEYNOTE-052, studio multicentrico, a braccio singolo, di fase 2, nel quale 370 pazienti hanno ricevuto almeno una dose di pembrolizumab. Anche in questo studio l’ORR è stato riportato al 27%.
Inoltre, l’uso clinico di pembrolizumab in prima linea è in corso di ulteriore valutazione in KEYNOTE-361, uno studio di fase 3, per indagare l’efficacia e la sicurezza del farmaco immunoterapico. Nonostante l’efficacia degli inhibitor checkpoint con tassi di risposta iniziale elevati, compresi tra il 40% e il 60%, la sopravvivenza a lungo termine resta però un endpoint difficilmente raggiungibile. La sopravvivenza mediana dei pazienti con UTUC metastatico trattati con la sola terapia sistemica rimane infatti inferiore a 2 anni. Alla luce di ciò, negli ultimi anni l’attenzione è stata posta sulla ricerca di un possibile approccio alternativo al trattamento dell’UC metastatico. Nell’ambito della malattia oligometastatica, il trattamento locale curativo delle singole lesioni è stato oggetto di numerosi studi, sia con approccio radioterapico che chirurgico.
In uno studio retrospettivo, Francolini et al. hanno evidenziato che il controllo locale della malattia, è stato raggiunto nel 68% delle lesioni metastatiche trattate con radioterapia stereotassica, rinnovando l’interesse per questa metodica. Nello studio prospettico proposto da Seisen et al. è stata avanzata l’ipotesi che il trattamento locale definitivo (chirurgia o radioterapia) fornisca un beneficio terapeutico nei pazienti con UTUC metastatico. In particolare lo studio è stato condotto arruolando 3753 pazienti, sottoposti a trattamento chemioterapico sistemico, di cui 297 (7.9%) hanno ricevuto un ulteriore trattamento locale concomitante. È stato evidenziato un beneficio in termini di overall survivor per i soggetti trattati con un trattamento locale rispetto a quelli trattati con la sola chemioterapia. La metastasectomia chirurgica nell’UTUC è stata proposta per la prima volta nel 1982 da Cowles et al., che nel loro studio condotto su 6 pazienti trattati con toracotomia per secondarismi polmonari da UTUC, hanno evidenziato un prolungamento dell’OS a 5 anni. Questo risultato è stato particolarmente impressionante, dato che la sopravvivenza mediana per l’UTUC metastatico al momento della pubblicazione era di soli 3 mesi. Da allora sono stati condotti numerosi studi sull’argomento. In particolare, Otto et al. in uno studio prospettico di fase 2 ha valutato l’efficacia della metastasectomia nell’UTUC metastatico refrattario alla chemioterapia, riportando una OS a 2 anni del 19% e una OS mediana di 7 mesi. La coorte comprendeva 70 pazienti, la maggior parte dei quali con più sedi di malattia (76%) e tutti con progressione della malattia dopo la chemioterapia MVAC iniziale. Le piccole dimensioni del campione e la variabilità delle caratteristiche dei pazienti selezionati per la metastasectomia rendono difficile trarre conclusioni definitive, soprattutto nell’individuazione dei criteri di selezione per la metastasectomia. Patel et al. hanno condotto una meta-analisi comprendente dati relativi a 412 pazienti con UTUC metastatico, evidenziando una migliore OS per i pazienti trattati con metastasectomia rispetto alla terapia sistemica (Figura 2).
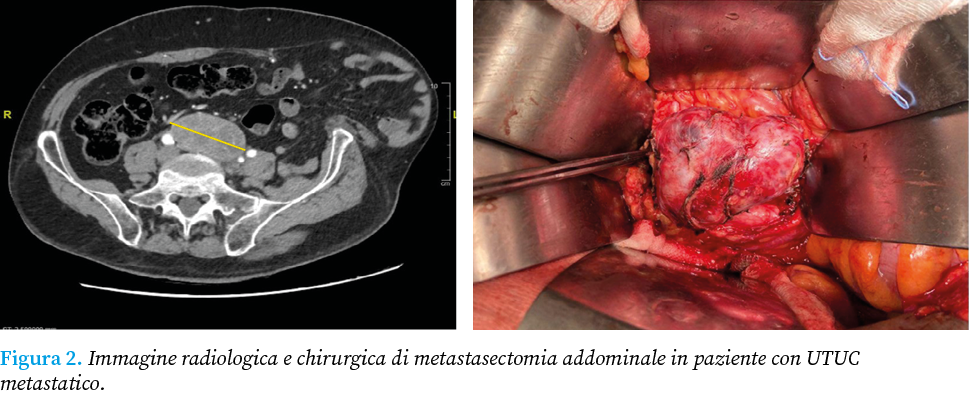
In particolare, il tempo medio di recidiva dopo metastasectomia era di 14.3 mesi con un OS a 5 anni dai 2 ai 60 mesi. Tuttavia, i dati disponibili in letteratura suggeriscono che i pazienti con malattia metastatica ed, in particolare, con lesioni limitate ai polmoni o ai linfonodi, sembrano beneficiare maggiormente di questo trattamento. Tuttavia ad oggi non è possibile identificare i pazienti idonei ad un trattamento combinato chemioterapico e metastasectomia. Alla luce di ciò, sembra necessario sviluppare modelli predittivi che incorporino le caratteristiche del paziente per determinare chi beneficerebbe della metastasectomia e/o di una terapia sistemica perioperatoria.
Si devono considerare l’estensione e le sedi della malattia metastatica, l’anamnesi e la risposta a trattamenti precedenti, i punteggi di performance individuali e l’intervallo libero da malattia.
Ulteriori studi dovrebbero valutare quali siano i parametri e le caratteristiche della neoplasia e del paziente
che possa presentare un outcome oncologico ottimale dopo terapia di combinazione.