

Il tumore della prostata (PCa) è la seconda neoplasia più comune negli uomini e la sesta causa di morte per cancro nel mondo (1). L’introduzione del test del PSA per la prevenzione secondaria, il miglioramento delle tecniche di biopsia e una popolazione maschile sempre più anziana ha portato ad un aumento significativo della detection del cancro della prostata. Questa malattia è caratterizzata da un lungo stadio pre-clinico latente che ne consente la diagnosi precoce, e da un tasso di crescita che, per la maggior parte dei tumori prostatici, è lento e relativamente costante nel tempo, a differenza di altri tipi di tumore. Studi autoptici hanno mostrato un’alta prevalenza di tumori alla prostata occulti, con un tasso dello 0,9%-30,4% tra gli uomini di età compresa tra 30 e 39 anni e del 21,2%-50,5% tra gli uomini di età compresa tra 70 e 79 anni, a seconda del gruppo etnico (2). Data la natura indolente e non invasiva della maggior parte dei tipi di tumore alla prostata, nonché il semplice fatto che la malattia sembra avere più probabilità di essere associata all’età piuttosto che ad altri fattori (50% degli uomini all’età di 50 anni e 80% degli uomini all’età di 80 anni (3), con o senza presentare alcun sintomo), la grande sfida di questa entità clinica era determinare indicatori di gravità per orientare il medico verso un atteggiamento adeguato in ambito clinico. Il rischio di una diagnosi e di un trattamento eccessivo di molti casi di cancro alla prostata è reale e pone molti punti interrogativi, il primo dei quali è se sia necessario trattarlo immediatamente o meno. Ed è proprio da questo che nasce la necessità di proporre ai pazienti con un tumore alla prostata, che presenti caratteristiche a basso rischio, un trattamento alternativo, come la sorveglianza attiva. Infatti, come è emerso dallo studio PIVOT, condotto su 731 pazienti con diagnosi di PCa localizzato, che hanno seguito un follow-up mediano di 10 anni, non vi è alcuna differenza statisticamente significativa tra i pazienti sottoposti a prostatectomia radicale (RP) e i pazienti sottoposti a sorveglianza attiva (AS), sia in termini di mortalità generale che di mortalità specifica per il cancro (mortalità correlata al trattamento per il cancro). Pertanto, i pazienti con malattia a basso rischio non trarrebbero beneficio dal trattamento chirurgico demolitivo, la prostatectomia radicale, il che giustificherebbe proporre la AS come alternativa (4). Innanzitutto, è necessario selezionare accuratamente i pazienti a cui proporre questo tipo di trattamento. A tale scopo sono stati creati protocolli come il PRIAS con l’obiettivo di fornire raccomandazioni basate sull’evidenza su come selezionare e seguire gli uomini con carcinoma della prostata a basso rischio in sorveglianza attiva (5). I criteri originali per l’inclusione erano Gleason score 6 (3+3), stadio non superiore a cT2c, PSA ≤10 ng/ml, due o meno cores positivi per PCa alla biopsia, PSA density ≤0,2 ng/ml/cm3. Nel 2012 e nel 2015 i criteri di inclusione sono stati modificati per includere i pazienti con una età superiore a 70 anni e un Gleason score (3+4) con un coinvolgimento tumorale <10%, ed adeguare il numero di cores positivi, data l’introduzione di biopsie mirate su risonanza magnetica (MRI) che ne aumentano la precisione (6). I pazienti in sorveglianza attiva seguono un programma di follow-up scandito da dosaggi ematici seriati del PSA, esplorazione digito-rettale, MRI e biopsie prostatiche per verificare la stabilizzazione della malattia ed individuare precocemente l’eventuale aumento di dimensioni del tumore, l’upstaging o la progressione della malattia che necessiterebbe di un trattamento con intento curativo. Il Gleason score alla prima biopsia è un importante predittore preoperatorio del carcinoma clinicamente localizzato, e quindi è una chiave di volta dei criteri clinico-patologici per la AS, anche se spesso l’esame istologico definitivo rivela uno score più alto. Precedenti studi hanno infatti documentato che sino al 60% dei tumori che alla biopsia erano stati classificati con uno score di Gleason 6, all’esame istologico definitivo dopo prostatectomia radicale avevano in realtà uno score di Gleason 7 o maggiore (7). Inoltre, i tumori a carico della porzione anteriore della prostata sono spesso non rilevati o sottovalutati durante la biopsia sistematica (8). Per superare queste limitazioni della biopsia è stata inserita la risonanza magnetica nel follow-up dei pazienti in sorveglianza attiva. Studi recenti hanno infatti dimostrato che la risonanza magnetica multiparametrica (mpRMI) è in grado di rilevare tumori significativi sia in pazienti naïve alla biopsia sia in pazienti con precedenti biopsie negative (9,10). La mpRMI ha un valore predittivo negativo per l’upgrading del Gleason molto vicino al 100% negli uomini in AS (12–14) ed al momento sembra il migliore metodo per escludere la presenza di uno score di Gleason più elevato. Se la risonanza magnetica è negativa, la AS può essere continuata. Tuttavia, la risonanza magnetica è risultata essere una metodica relativamente scadente nell’identificare i tumori a basso rischio a causa della risoluzione ancora limitata (11), ma nel contesto della AS questo è un dato che possiamo trascurare. Anzi è possibile sfruttare la capacità della risonanza magnetica multiparametrica di individuare con più precisione lesioni clinicamente significative, cioè con Gleason score ≥7, volume del tumore ≥0,5 cm3 od estensione extracapsulare, rispetto ad altri tipi di lesione. Ed è proprio questo che è emerso dallo studio di Park et al., in cui utilizzando la classificazione PIRADSv2 per predire il carcinoma clinicamente significativo preoperatorio, è possibile sfruttare il potenziale della risonanza magnetica multiparametrica per la selezione dei pazienti che necessitano di un trattamento definitivo e quelli che invece è possibile seguire con la sorveglianza attiva, in aggiunta ai parametri del PRIAS (9). Infatti, i parametri del PRIAS dovrebbero essere utilizzati per la selezione iniziale dei candidati idonei per AS e solo dopo dovrebbero essere valutate le immagini di risonanza magnetica classificate secondo il PIRADSv2 per escludere pazienti ad alto rischio. Una recente revisione sistematica di Cantiello et al. ha riportato i dati qualitativi e quantitativi di 43 studi con 6.605 pazienti in AS sottoposti a mpMRI durante il follow-up, rivelando che per i pazienti in AS, una strategia che include mpMRI durante il follow-up potrebbe aggiungere un ulteriore vantaggio nel rilevare la progressione o la riclassificazione del PCa al momento della re-biopsia, a prescindere dalle sue dimensioni (15). I risultati sull’accuratezza diagnostica cumulativa della mpMRI eseguita con 1,5 Tesla o 3,0 Tesla non hanno evidenziato alcuna differenza tra le due metodiche in riferimento al valore predittivo negativo (75% vs 78%) sebbene una maggiore precisione sia stata dimostrata con quest’ultima (74% vs 83%). La Figura 1 mostra le specificità e le sensibilità dei più recenti studi sul ruolo della sorveglianza attiva nel follow-up del carcinoma prostatico, in accordo alla tipologia di campo, 1,5 Tesla (a) o 3,0 Tesla (b). Il problema principale della risonanza magnetica multiparametrica della prostata non è valutarne il vantaggio rispetto alla biopsia prostatica sistematica, ma il suo ruolo in un contesto longitudinale di pazienti con carcinoma della prostata che vengono seguiti nel tempo. Determinare la progressione del tumore nei pazienti con AS è una sfida importante ed evitare una biopsia non necessaria potrebbe consentire ai pazienti significativi vantaggi in termini di complicanze e ansia. Nel prossimo futuro, la risonanza magnetica potrebbe persino essere in grado di sostituire le biopsie sistematiche del tutto, che attualmente si dimostrano inutili nel 75% degli uomini in sorveglianza attiva, poiché non evidenziano un upstaging della malattia (6). Quindi nei pazienti in sorveglianza attiva il ruolo della risonanza magnetica è triplice: inizialmente nella selezione dei candidati con malattia realmente a basso rischio, per una più accurata scelta dei candidati; durante il follow-up per il riconoscimento dell’upgrading delle lesioni e quindi dell’eventuale necessità di intraprendere un trattamento attivo; ed infine, il valore aggiunto della risonanza magnetica multiparametrica della prostata risiede nell’ evitare l’esecuzione di biopsie ripetute inutili ed invasive che rendono più difficile da seguire e sopportare il percorso di sorveglianza attiva.
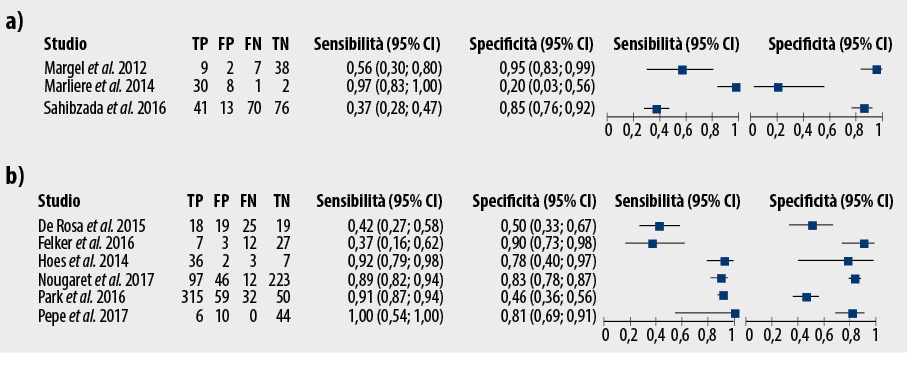
Figura 1. Specificità e le sensibilità dei più recenti studi sul ruolo della sorveglianza attiva nel follow-up del carcinoma prostatico, in accordo alla tipologia di campo, 1,5 Tesla (a) o 3,0 Tesla (b).