
 Il dolore da cancro è una condizione tuttora piuttosto diffusa che comporta un notevole impatto clinico ed emozionale sulla vita del paziente. Questo dato appare incontrovertibile, nonostante l’impegno consapevole degli operatori sanitari, la diffusione di programmi educazionali e di interventi delle varie organizzazioni nazionali e internazionali per richiamare l’attenzione della comunità scientifica su questa delicata problematica.
Il dolore da cancro è una condizione tuttora piuttosto diffusa che comporta un notevole impatto clinico ed emozionale sulla vita del paziente. Questo dato appare incontrovertibile, nonostante l’impegno consapevole degli operatori sanitari, la diffusione di programmi educazionali e di interventi delle varie organizzazioni nazionali e internazionali per richiamare l’attenzione della comunità scientifica su questa delicata problematica.
Secondo una review sistematica recente (1) la prevalenza del dolore oncologico è pari a circa il 33% nei pazienti che sono stati sottoposti a trattamento curativo ed arriva al 59% nei pazienti in terapia e al 64% nei malati con malattia metastatica o terminale.
Il fenomeno del sottotrattamento del dolore da cancro rappresenta dunque un fenomeno evidente: quasi un paziente su due non riceve un trattamento ottimale (2-4).
A commento di questi dati, le linee guida AIOM fanno giustamente notare che “prima di considerare inefficace o poco attiva una strategia terapeutica come, per esempio, la Scala Analgesica dell’Organizzazione Mondiale della Sanità, andrebbe verificato il suo livello di corretta applicazione” (5).
Ricordiamo che la cosiddetta Analgesic Ladder dell’OMS (6) suggerisce l’impiego di FANS e Paracetamolo nel dolore lieve (farmaci del primo gradino), di “oppioidi deboli” per il dolore lieve-moderato (farmaci del secondo gradino), associati o meno a farmaci del primo gradino, e di “oppioidi forti” per il dolore moderato-severo (farmaci del terzo gradino), associati o meno a farmaci del primo.
E’ da notare che gli oppioidi del “secondo gradino” sono caratterizzati dal cosiddetto effetto-tetto, ossia dalla presenza di un dosaggio massimale di farmaco oltre il quale peggiora l’indice terapeutico in quanto, in assenza di effetto terapeutico aggiuntivo, aumentano, per contro, gli effetti collaterali.
IL RUOLO DEGLI OPPIOIDI: DALLE LINEE GUIDA ALLA PRATICA CLINICA
Un impiego efficace e attento degli oppioidi rappresenta il cardine della terapia del dolore cronico in generale e del dolore oncologico in particolare (7).
Abbiamo già accennato all’importanza di applicare correttamente algoritmi terapeutici come quelli proposti dall’OMS, ma anche in questo caso è bene precisare che occorre esercitare una scelta critica e adattare le strategie ai diversi casi specifici.
Si è molto discusso, ad esempio, del cosiddetto “salto” del secondo gradino ovvero dell’opportunità di impiegare più precocemente (subito dopo i FANS) i cosiddetti oppioidi forti. E’ questa una scelta che, attentamente ponderata, può rappresentare un’opzione razionale nell’intento di ottimizzare il controllo del dolore da cancro.
Le stesse linee guida AIOM raccomandano che benché per i pazienti con dolore moderato-severo non adeguatamente controllato dagli analgesici del primo scalino l’aggiunta di un oppioide del II scalino (es. codeina, tramadolo) possa raggiungere un buon sollievo del dolore, è in ogni caso da considerare l’alternativa di usare direttamente “basse dosi di un oppioide del III scalino (es. morfina, ossicodone)” (5).
Sono dunque le stesse linee guida a teorizzare, in casi specifici, il cosiddetto “salto” del secondo gradino.
Riguardo poi agli oppioidi forti, le evidenze disponibili non suggeriscono significative differenze tra morfina, ossicodone, ed idromorfone somministrati per via orale e dunque uno di questi tre farmaci può essere usato come oppioide di prima scelta del III scalino per il dolore moderato-severo da cancro (lineeguida AIOM) (5).
Tale raccomandazione mette in discussione alcuni assiomi fin troppo consolidati nella pratica terapeutica come quello che considera, ad esempio, la morfina come il gold standard di questo tipo di trattamento. Questi assiomi sono da considerarsi in parte obsoleti, anche alla luce, di alcune evidenze sul profilo di tollerabilità di alcuni protocolli terapeutici. Una pubblicazione recente (Suzuki et al dicembre 2012) ha valutato ad esempio i potenziali effetti immunosoppressivi della morfina studiando l’associazione tra la somministrazione di morfina o di ossicodone e lo sviluppo di infezioni nei pazienti oncologici. Si tratta di una ricerca piuttosto ampia che ha coinvolto più di ottocento pazienti trattati con un oppioide per più di 10 giorni consecutivi. E’ emerso così che il rischio di infezioni è significativamente più elevato nei pazienti trattati con morfina, con un odds ratio = 3.60 (IC= 1.40-9.26) rispetto all’ossicodone . Al di là di eventuali fattori confondenti, gli autori concludono che effettivamente l’uso di morfina può comportare un certo rischio di infezioni in ragione del potenziale immunosoppressivo proprio di questo farmaco (8).
Anche in relazioni a evidenze di questo tipo, le linee guida AIOM ed ESMO, affermano che l’ossicodone nella sua formulazione a rilascio controllato rappresenta una valida alternativa alla morfina orale nel paziente anziano con dolore di grado moderato severo (5, 7).
Le medesime linee guida contribuiscono a chiarire il ruolo delle diverse formulazioni, restringendo ad esempio, l’indicazione delle formulazioni transdermiche alla presenza di condizioni che rendano impossibile l’assunzione orale (es. impossibilità a deglutire) (5), mentre la via parenterale (e.v. o s.c.) viene consigliata per il controllo del dolore in pazienti con inadeguata analgesia con il trattamento orale (quindi, in sostanza, considerata di seconda scelta) (5).
Dall’altro lato si insiste su un uso congruo e non dilazionato degli oppiacei specie in pazienti particolari, quali ad esempio i soggetti anziani, utilizzando sempre le dosi minime efficaci e preferendo i farmaci ad emivita breve o intermedia a quelli ad emivita lunga (il metadone rappresenterebbe dunque una seconda scelta, mentre l’opzione preferenziale sarebbe a favore di altri oppioidi più adatti anche per ragioni di farmacocinetica, quali appunto il già citato ossicodone) (tabella 1).
 |
Come emerge dunque da queste raccomandazioni, i dati recenti e le evidenze pubblicate, soprattutto da review e metanalisi internazionali, tendono a ridefinire paradigmi più o meno diffusi nell’ambito del trattamento del dolore oncologico e ciò nell’ottica di ridurre e contenere entro limiti tollerabili il fenomeno del sottotrattamento del dolore da cancro.
OPPIOIDI E TOLLERABILITA’ : LA GESTIONE DEGLI EFFETTI COLLATERALI
Un’altra problematica da valutare con attenzione, nell’ottica di ottimizzare l’approccio al trattamento del dolore oncologico, è il profilo di sicurezza e di tollerabilità dei diversi farmaci. Le Linee Guida AIOM sottolineano come la gestione degli effetti collaterali da oppioidi rappresenti un presupposto essenziale per il trattamento del dolore, non meno importante della stessa analgesia (5). In tabella 2 riportiamo gli effetti collaterali più comunemente segnalati nel corso del trattamento con farmaci oppioidi.
 |
Per la gestione degli eventi avversi da oppioidi le linee guida AIOM suggeriscono una serie di interventi. Non tutte le indicazioni sono corroborate da evidenze stringenti, tuttavia vengono indicati diversi tipi di intervento farmacologico, dagli psicostimolanti per il controllo della sedazione, ai neurolettici per il delirium (5).
A tale riguardo, dalla serie di raccomandazioni emerge il ruolo potenzialmente molto utile dei antagonisti dei recettori oppioidi nel controllo di diversi effetti collaterali. In particolare, il naloxone, in ragione della sua attività di antagonista puro che agisce su tutti e tre i recettori oppioidi (κ, μ e δ del cervello, del midollo spinale e degli organi periferici, ad esempio dell'intestino) (9) può essere molto efficace nel controllo della depressione respiratoria (per la quale se ne consiglia naturalmente un impiego tempestivo) e nel controllo o prevenzione del prurito, della nausea, del vomito e della stipsi (5).
Le linee guida ESMO riportano che tra le nuove formulazioni disponibili, l’associazione ossicodone/naloxone dimostra una buona efficacia analgesica e una minore incidenza di effetti collaterali (7), sottolineando in particolare l’effetto positivo sul controllo della stipsi (7).
Di seguito passeremo in rassegna alcuni dati interessanti che riguardano il profilo farmacologico e clinico di questa associazione a dosaggio fisso.
L’ASSOCIAZIONE OSSICODONE/NALOXONE: ESPERIENZE CLINICHE NEL TRATTAMENTO DEL DOLORO ONCOLOGICO
Somministrato per via orale, il Naloxone presenta una biodisponibilità sistemica molto bassa, < 3% in ragione di un esteso metabolismo di primo passaggio epatico. Di conseguenza questo antagonista oppioide agisce in misura preferenziale sui recettori oppioidi del tratto gastroenterico (10). I risultati di studi farmacocinetici dimostrano che la co-somministrazione di ossicodone a rilascio prolungato (RP) e di naloxone RP in un’associazione a dosaggio fisso non interferisce significativamente con la biodisponibilità dei due singoli composti (10).
Come tale, l’associazione ossicodone RP/naloxone RP dimostra un’efficace attività analgesica nei pazienti con dolore cronico grave e, in aggiunta, assicura un buon controllo dei disturbi intestinali e in particolare della stipsi da oppioidi (10).
Di recente sono stati pubblicati i risultati di due studi di estensione (10) in cui quasi 400 pazienti che avevano già completato una fase preliminare in doppio cieco sono stati trattati in aperto con ossicodone RP ⁄ naloxone RP fino a 52 settimane, con l’obiettivo di studiare gli effetti a lungo termine e la sicurezza della terapia. Il dolore medio nelle 24 ore (uno degli item della scala BPI per la valutazione del dolore) è rimasto stabilmente ben controllato (ovvero il punteggio relativo si è mantenuto costantemente basso) sia a 6 che a 12 mesi di trattamento (figura 1), dimostrando quindi l’efficacia dell’associazione anche nella terapia a lungo termine. Il trattamento ha migliorato inoltre la qualità di vita del paziente come dimostra la riduzione dell’interferenza del dolore sul sonno e sulle attività quotidiane del paziente (anche questi punteggi si sono mantenuti bassi durante l’intero periodo di trattamento).
| Figura 1. Andamento del punteggio relativo al “dolore medio nelle 24 ore”, item della scala Brief Pain Inventory (BPI) Short Form [riprodotta da (10)] 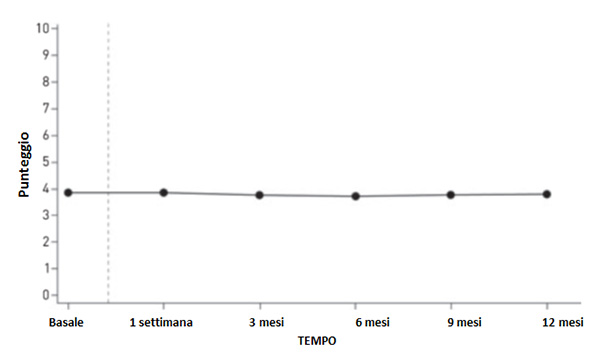 |
L’associazione ossicodone RP/naloxone RP ha migliorato anche la funzione intestinale come dimostra la riduzione del punteggio dell’indice BFI (Bowel Function Index) da 35.6 ± 27.74 all’inizio della fase in aperto a 20.6 ± 24.01 dopo 12 mesi di trattamento (10). E’ interessante notare che una parte dei pazienti, che era stata trattata con solo ossicodone nella fase iniziale in doppio cieco, ha manifestato un rapido miglioramento della sindrome intestinale già nella prima settimana della fase in aperto, a testimonianza della rapida azione del naloxone sui sintomi gastroenterici. Il miglioramento della stipsi e degli altri sintomi gastroenterici è stato ottenuto senza alcun decremento dell’efficacia analgesica della terapia.
Un altro studio pubblicato di recente (11) ha confermato questi risultati e ha dimostrato che in pazienti con dolore oncologico moderato grave e stipsi, in terapia con oppioidi, il trattamento con l’associazione ossicodone/naloxone RP assicura un buon controllo del dolore e migliora in misura clinicamente rilevante e statisticamente significativa i disturbi intestinali rispetto al trattamento con solo ossicodone, già a partire dalla prima settimana (figura 2).
Figura 2. Effetto dell’associazione Ossicodone/Naloxone RP (OXN PR) e di Ossicodone RP in monoterapia (OxyPR) sul punteggio medio (± standard error) dell’indice BFI relativo alla funzione intestinale (popolazione full analysis II, LOCF), nei pazienti trattati [modificata da (11)] |
CONCLUSIONE
Il dolore da cancro rappresenta una condizione ancora diffusa, a notevole impatto sulla salute e sulla qualità di vita del paziente. L’applicazione ragionata degli algoritmi terapeutici raccomandati consente un approccio efficace a questa condizione. A tale proposito le lineeguida consigliano di prendere in considerazione l’eventualità di un impiego precoce degli “oppioidi forti” in presenza di condizioni che suggeriscano il cosiddetto “salto” del secondo gradino. Gli oppioidi forti, impiegati alle minime dosi efficaci, sono farmaci molto utili nel trattamento del dolore da cancro. Sono da preferire le molecole (ad esempio l’ossicodone) dotate di emivita breve o intermedia e di un buon profilo di sicurezza.
Un altro aspetto importante nella terapia del dolore oncologico è il controllo e/o la prevenzione degli effetti collaterali degli oppioidi. A tale scopo l’associazione di un antagonista dei recettori oppioidi è particolarmente indicata per la prevenzione dei disturbi gastrointestinali (nausea, vomito e soprattutto la stipsi) che si presentano frequentemente durante il trattamento con farmaci oppioidi. L’associazione ossicodone/naloxone RP a dosaggio fisso rappresenta una combinazione ben bilanciata per il trattamento del dolore da cancro: essa ha dimostrato una buona efficacia nel controllo del dolore moderato-grave e ha garantito un buon profilo di sicurezza. Ossicodone/naloxone RP ha anche migliorato la qualità di vita del paziente riducendo l’interferenza del dolore sul sonno e sulle attività quotidiane.
BIBLIOGRAFIA
1. Van den Beuken-van Everdingen MHJ, De Rijke JM, Kessels AG et al. Prevalence of pain in patients with cancer: a systematic review of the past 40 years. Ann Oncol 2007; 18: 1437–1449.
2. Deandrea S, Montanari M, Moja L, et al. Prevalence of under treatment in cancer pain. A review of published li-terature. Ann Oncol 2008; 19: 1985-1991
3. Cleeland CS, Gonin R, Hatfield AK, et al: Pain and its treatment in outpatients with metastatic cancer. N Eng J Med 1994; 330: 592-596
4. Buenaver LF, Edwards RR, Haythornthwaite JA. Pain-related catastrophizing and perceived social responses: inter-relationships in the context of chronic pain. Pain 2007 127: 234–242
5. AIOM Linee guida Terapia del dolore Oncologico 2012
6. World Health Organization: Cancer pain relief. World Health Organization, Geneva, 1986
7. Ripamonti CI et al Annals of Oncology 2012: 23 (Supplement 7): vii 139–vii 154
8. Suzuki M et al Am J Hosp Palliat Care. 2012 Dec 21 Epub. Ahead of print
9. RCP Targin
10. Sandner-Kiesling A. Int J Clin Pract, May 2010, 64, 6, 763–774
11. Ahmezai A. et al . Palliat Med. 2012 Jan;26(1):50-60.